Wegweisendes Leukämie-Medikament jetzt auch in Europa zugelassen
Gazyvaro (Obinutuzumab), ein wegweisendes Medikament zur Behandlung der chronischen lymphatischen Leukämie (CLL), ist nun auch in Europa zugelassen. Das neue Medikament ermöglicht den Betroffenen im Vergleich zur bisherigen Standardtherapie ein längeres progressionsfreies Leben bei guter Verträglichkeit. Gazyvaro wurde von Roche entwickelt, in Deutschland geprüft und wird hier auch für den weltweiten Markt produziert. In den USA hatte die zuständige Behörde dem neuen Medikament als weltweit erstem das Prädikat eines „Therapiedurchbruchs“ zugesprochen und Obinutuzumab Ende 2013 in einem beschleunigten Verfahren genehmigt.
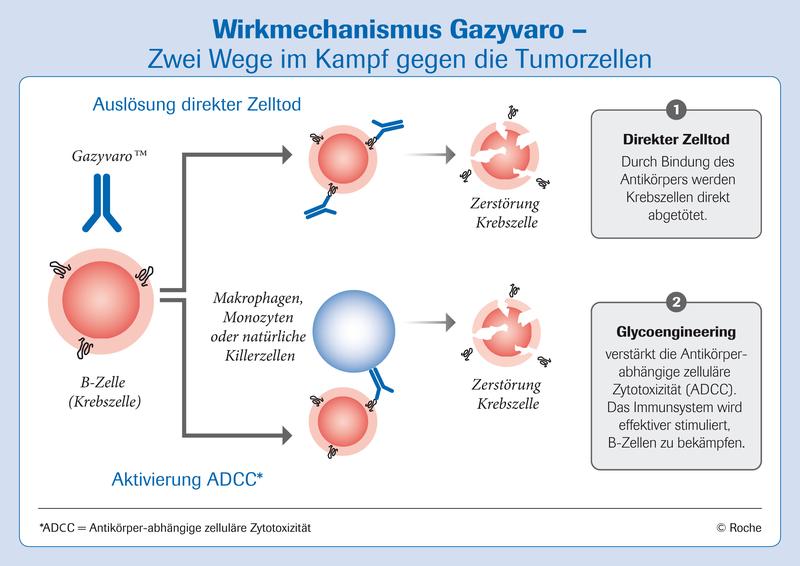
Mit Obinutuzumab steht ein neuer Wirkstoff für die Krebstherapie zur Verfügung, und zwar zur Behandlung der häufigsten Leukämieform in der westlichen Welt, der CLL. Das Besondere an dem Antikörper Obinutuzumab ist seine ausgeklügelte Konstruktion, die ihn von bisherigen auf dem Markt befindlichen Antikörpern abhebt: Er animiert das Immunsystem verstärkt zum Angriff auf Krebszellen, kann aber auch selbst den direkten Zelltod auslösen (Abb.1). Das Medikament wurde unter anderem von der weltweit renommierten, deutschen CLL-Studiengruppe (DCLLSG) an der Universitätsklinik Köln klinisch erforscht und im Biotechnologie-Zentrum von Roche im bayerischen Penzberg mitentwickelt und produziert – es ist eine echte Innovation “made in Germany”.
Grundlage für die Zulassung der European Medicines Agency (EMA) ist die klinische Studie CLL11, die Roche gemeinsam mit der DCLLSG durchgeführt hat. Dabei erprobte die Gruppe unter der Leitung von Prof. Dr. Michael Hallek das neue Medikament an 781 Patienten mit Begleiterkrankungen – typischen CLL-Betroffenen also. Die renommierte US-Fachzeitschrift New England Journal of Medicine veröffentlichte Anfang des Jahres eine Auswertung der Untersuchung 1.
Beeindruckende Ergebnisse
Für Prof. Dr. Michael Hallek, Direktor der Klinik I für Innere Medizin an der Universitätsklinik Köln, hat die Studie einen besonderen Stellenwert: „Die Zulassungsstudie zeigt: Gazyvaro verlängert das Leben der CLL-Patienten. Gegenüber der alleinigen Chemotherapie hat sich der Zeitraum bis zum Fortschreiten der Erkrankung mehr als verdoppelt. Das sind beeindruckende Ergebnisse. Gazyvaro wird die CLL-Therapie entscheidend verbessern.“
Für die Studie wurden die Teilnehmer in drei Gruppen aufgeteilt. Ein Teil erhielt die derzeit empfohlene Chemotherapie mit dem Wirkstoff Chlorambucil, die zweite Gruppe bekam diese Chemotherapie zusammen mit dem langjährig bewährten Therapiestandard dem Antikörper Rituximab von Roche und der dritten Gruppe wurde Chlorambucil und der neue monoklonale Antikörper Obinutuzumab gegeben. Dabei zeigte Obinutuzumab ein signifikant längeres progressionsfreies Überleben. Eine nachfolgende zweite Auswertung, in der Obinutuzumab und Rituximab direkt verglichen wurden, ergab klare Vorteile für Gazyvaro: Im Vergleich zu Patienten, die Rituximab plus Chlorambucil erhalten hatten, lebten die Patienten in der Obinutuzumab-Gruppe 11,5 Monate länger ohne Fortschreiten der Erkrankung. Bei mehr als zehnmal so vielen Patienten konnte die Erkrankung im Blut selbst mit feinsten Analysemethoden nicht mehr nachgewiesen werden (37,7 % statt 3,3 %).
„Wir freuen uns, dass die EU-Kommission die europaweite Zulassung für Gazyvaro zur Behandlung typischer CLL-Patienten mit Begleiterkrankungen erteilt hat“, so Stefan Frings, Medizinischer Direktor der Roche Pharma AG. „Mit Gazyvaro können wir eine bedeutsame therapeutische Innovation als neue Basis zur Behandlung von Patienten dieser Erkrankung zur Verfügung stellen“.
Die Zulassungsstudie zeigt, dass Obinutuzumab gut verträglich ist. Nach der ersten Gabe treten vermehrt infusionsassoziierte Reaktionen wie Übelkeit, Fieber, Schüttelfrost und Blutdruckabfall auf, die möglicherweise mit der besonderen Wirksamkeit von Obinutuzumab zusammenhängen und sich gut behandeln lassen. Insgesamt traten in der Studie keine bei Anti-CD20-Antikörpern bisher unbekannten Nebenwirkungen auf – ein Befund, der mit Blick auf medizinische Fitness und Gesundheitszustand der Probanden bemerkenswert ist.
___
1 Goede, Valentin, et.al., New England Journal of Medicine 2014; 370 (12): 1101-10
Weitere Informationen:
http://pharma.roche-presse.de/de/gazyvaro/publikumspresse/index.php - Hintergrund
http://pharma.roche-presse.de/de/gazyvaro/publikumspresse/infografiken.php - Infografiken
http://pharma.roche-presse.de/de/gazyvaro/publikumspresse/videos.php - Videos
Ähnliche Pressemitteilungen im idw