Jahrestagung DGHO 2017: Beginnt mit Venetoclax ein neues Zeitalter in der Therapie der CLL?
Wiesbaden, 2. November 2017 – Ein Paradigmenwechsel in der Behandlung von chronischer lymphatischer Leukämie (CLL): Das kündigte sich während des Vortrages von Professor Wolfgang Knauf, Frankfurt, während des AbbVie Symposiums an. Denn mit Venetoclax, dem oralen Inhibitor des B-Zell-Lymphom-2-Proteins (BCL-2), kann ein tiefes Ansprechen auch bei Patienten erreicht werden, bei denen es nach Chemoimmuntherapie und einer Therapie mit Inhibitoren des B‐Zell‐Rezeptor‐Signalwegs (BCRi) zum Progress kommt.(1) Ebenso zeigen vorbehandelte CLL-Patienten mit 17p-Deletion und/oder TP53-Mutation, bei denen BCRi versagten, ein gutes Ansprechen.(1,2)
Neue zielgerichtete Substanzen wie Venetoclax zeigen hohe Ansprechraten bis hin zu einer nicht mehr nachweisbaren minimalen Resterkrankung (MRD).(1) „Bisherige Therapieziele müssen daher neu definiert werden“, schlussfolgerte Knauf. „Und es stellt sich die Frage, inwieweit das aus der Zeit der Chemo-Immuntherapie stammende Paradigma „je wirksamer desto toxischer“ neu überdacht werden muss.“ Venetoclax zeigte in den Zulassungsstudien mit vorbehandelten CLL-Patienten ein tiefes und anhaltendes Ansprechen.(1,2) Die Zeit bis zum ersten Ansprechen betrug im Median 0,8 Monate, vollständige Remissionen traten im Median nach acht Monaten auf.(2) Dabei waren die häufigsten (≥ 10%) Nebenwirkungen (Grad 3 bis 4) Neutropenie (39 %), Thrombozytopenie (15 %) und Anämie (14 %).(3) Professor Knaufs Resümee: „Schaut man sich die Wirksamkeit im Verhältnis zu den Nebenwirkungen an, gibt es keine bessere Alternative zu Venetoclax innerhalb der zugelassenen Indikation.“
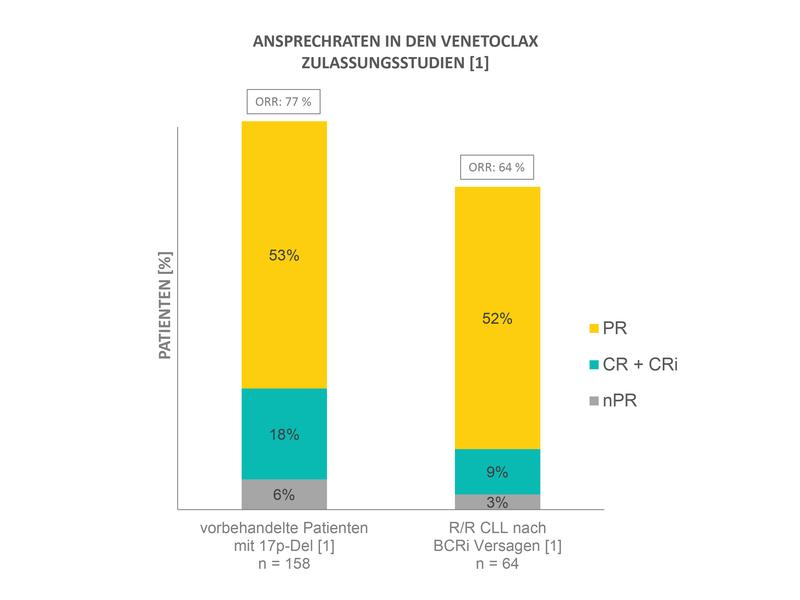
Bis zu 77 % Gesamtansprechraten bei schwer behandelbaren CLL-Patienten mit und ohne 17p-Deletion
In der schwer behandelbaren Gruppe vorbehandelter CLL-Patienten mit 17p‐Deletion betrug die Gesamtansprechrate (ORR) unter Venetoclax 77 % nach einer medianen Behandlungsdauer von 16,7 Monaten.(3) Bei 18 % der Patienten wurde eine komplette Remission (CR) oder komplette Remission mit unvollständiger Knochenmarkregeneration (CRi) erreicht, und 53 % zeigten eine partielle Remission (PR) (Abb.1).(1,3) Das geschätzte progressionsfreie Überleben (PFS) und das Gesamtüberleben (OS) über einen Zeitraum von 24 Monaten liegt bei 52 % bzw. 72 %.(3) Bei 5 % der Patienten trat ein Labor‐TLS auf, das in allen Fällen ohne klinische Konsequenzen blieb und gut handhabbar war.(1,3) Bei 27 % konnte im peripheren Blut mittels Durchflusszytometrie keine MRD mehr nachgewiesen werden.(3) Ein negativer MRD-Status ist ein Prädiktor für progressionsfreies Überleben (PFS) und Gesamtüberleben (OS).(4)
In der besonders ungünstigen Therapiesituation von CLL-Patienten (mit und ohne 17p-Deletion), die nach einer Therapie mit den BCRi Ibrutinib bzw. Idelalisib einen Progress zeigten, wurde nach ersten Ergebnissen einer Phase-II-Studie unter Venetoclax eine ORR von 67 % (Arm A; nach Ibrutinib) bzw. 57 % (Arm B; nach Idelalisib) und von 64 % für die gesamte Studienpopulation festgestellt.(1) Nach Beurteilung des Prüfers erzielten 7 % der Patienten in Arm A, 14 % in Arm B und 9 % der gesamten Studienpopulation eine CR und CRi. Eine PR erreichten 56 % (Arm A), 43 % (Arm B) bzw. 52 % in der gesamten Studienpopulation (Abb.1). Der Median für das PFS sowie der Median für das OS wurde noch nicht erreicht.(1)
Venetoclax wird derzeit auch in Kombinationstherapien erforscht: Eine randomisierte Phase-III-Studie zu Venetoclax in Kombination mit Rituximab erreichte den primären Endpunkt eines verlängerten PFS im Vergleich zu Bendamustin in Kombination mit Rituximab bei Patienten mit rezidivierter/refraktärer (R/R) CLL.
Über Venetoclax
Venetoclax ist ein oraler Inhibitor des B-Zell-Lymphom-2-Proteins (BCL-2). Die Substanz wurde für die Behandlung verschiedener Krebserkrankungen entwickelt. Das BCL-2-Protein, das die Apoptose einiger Zelltypen (darunter auch Lymphozyten) verhindert, kann bei einigen Krebserkrankungen überexprimiert sein. Venetoclax inhibiert selektiv die Funktion von BCL-2. Der Inhibitor wurde von AbbVie in Zusammenarbeit mit Genentech und Roche entwickelt. Venetoclax ist zugelassen als Monotherapie bei Erwachsenen zur Behandlung einer CLL, die eine 17p-Deletion oder TP53-Mutation aufweisen und die für eine Behandlung mit einem Inhibitor des B-Zell-Rezeptor-Signalwegs nicht geeignet sind oder ein Therapieversagen zeigten.(1) Außerdem kann Venetoclax in der Monotherapie bei Erwachsenen zur Behandlung einer CLL ohne Vorliegen einer 17p-Deletion oder TP53-Mutation eingesetzt werden, bei denen sowohl unter einer Chemo-Immuntherapie als auch unter einem Inhibitor des B-Zell-Rezeptor-Signalwegs ein Therapieversagen auftrat.(1) Darüber hinaus werden derzeit Studien bei weiteren Tumorentitäten durchgeführt.
Über AbbVie in der Onkologie
AbbVies Bestreben ist es, den Krebs zu besiegen. Das Unternehmen baut dabei auf die Zusammenarbeit in der Onkologie-Community, die Wissenschaftler, Ärzte, andere Unternehmen der Branche, Patientenorganisationen und Patienten umfasst. Das Ziel ist, Arzneimittel zur Verfügung zu stellen, die die Therapie und die Behandlungsergebnisse bei Krebspatienten auf eine völlig neue Ebene heben und die weltweit einen echten Unterschied im Leben von Menschen machen. Durch Erforschung und Investitionen in neue Technologien und Therapieansätze setzt AbbVie neue Maßstäbe bei der Behandlung einiger der am schwersten zu behandelnden Krebserkrankungen.
Durch die Übernahme von Pharmacyclics 2015 und Stemcentrx 2016 sowie durch verschiedene Kooperationen mit externen Partnern umfasst das Onkologieportfolio von AbbVie zugelassene Therapien sowie eine robuste Pipeline mit zahlreichen neuen Molekülen, die weltweit in nahezu 200 klinischen Studien zu 20 verschiedenen Tumorarten untersucht werden.
Über AbbVie
AbbVie (NYSE: ABBV) ist ein globales, forschendes BioPharma-Unternehmen, das sich der Entwicklung innovativer Therapien für einige der komplexesten und schwerwiegendsten Erkrankungen der Welt verschrieben hat. Mission des Unternehmens ist es, mit seiner Expertise, seinen engagierten Mitarbeitern und seinem Innovationsanspruch die Behandlungsmöglichkeiten in vier Therapiegebieten deutlich zu verbessern: Immunologie, Onkologie, Virologie und Neurowissenschaften. In mehr als 75 Ländern arbeiten AbbVie-Mitarbeiter jeden Tag daran, die Gesundheitsversorgung für Menschen auf der ganzen Welt voranzutreiben. In Deutschland ist AbbVie an seinem Hauptsitz in Wiesbaden und seinem Forschungs- und Produktionsstandort in Ludwigshafen vertreten. Insgesamt beschäftigt AbbVie Deutschland rund 2.600 Mitarbeiter. Weitere Informationen zum Unternehmen finden Sie unter www.abbvie.com und www.abbvie.de. Folgen Sie @abbvie_de auf Twitter oder besuchen Sie unsere Profile auf Facebook oder LinkedIn.
Kontakt
AbbVie Deutschland GmbH & Co. KG
Maren Nienstedt
Communication Manager Hematology & Oncology
Mainzer Straße 81
65189 Wiesbaden
T: +49 611 1720 - 2382
E-Mail: maren.nienstedt@abbvie.com
Literatur
1 Fachinformation Venclyxto®; Stand: April 2017
2 Stilgenbauer S et al. (2016) Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion. A multicentre, open-label, phase 2 study. The Lancet Oncology 17(6):768–778. doi:10.1016/S1470-2045(16)30019-5
3 Stilgenbauer S et al. Venetoclax in relapsed/refractory chronic lymphocytic leukemia (CLL) with 17p deletion: outcome and minimal residual disease from the full population of the pivotal M13-982 trial. Abstract S771. Vorgestellt auf dem Kongress der Europäischen Gesellschaft für Hämatologie 2017 am 25. Juni 2017. Abrufbar unter: https://learningcenter.ehaweb.org/eha/2017/22nd/182058/stephan.stilgenbauer.venetoclax.in.relapsed.refractory.chronic.lymphocytic.html?f=m3e1181. Letzter Zugriff: 24.10.2017
4 Kwok M et al. (2016) Minimal residual disease is an independent predictor for 10-year survival in CLL. Blood 128(24):2770–2773. doi:10.1182/blood-2016-05-714162
Die semantisch ähnlichsten Pressemitteilungen im idw