Aufbau sozialer Netzwerke im Gehirn
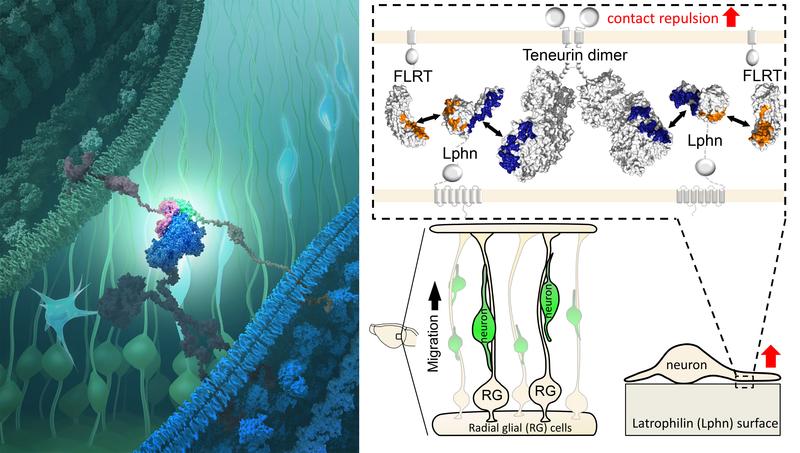
Die drei Proteine Teneurin, Latrophillin und FLRT halten zusammen und bringen benachbarte Nervenzellen in Kontakt, damit sich Synapsen bilden und die Zellen Informationen austauschen können. In der Frühphase der Gehirnentwicklung führt die Interaktion derselben Proteine jedoch dazu, dass sich wandernde Nervenzellen abstoßen, wie Forscher des Max-Planck-Instituts für Neurobiologie und der Universität Oxford jetzt zeigen. Der detaillierte Einblick in die molekularen Lenkmechanismen der Gehirnzellen wurde erst durch Strukturanalysen der Proteinkomplexe möglich.
Gut verankert sitzen die Proteine Teneurin und FLRT auf der Oberfläche von Nervenzellen. Sie halten Ausschau nach ihrem Partnerprotein, Latrophilin, auf anderen Nervenzellen. Kommen die drei Proteine in Kontakt, verankern sie sich und halten die Zellmembranen zusammen. Dann lösen sie noch weitgehend unbekannte Signalketten aus und fördern so die Synapsenbildung an dieser Stelle.
Dass Teneurin und seine Partnerproteine diese wichtigen Zellkontakte im Gehirn herstellen, ist bekannt. Teneurin ist zudem ein evolutionsbiologisch sehr altes Protein, das in ähnlichen Versionen in Bakterien, Würmern, Fruchtfliegen bis hin zu Wirbeltieren vorkommt. Was diese Proteine jedoch während der Entwicklung des Gehirns machen, wenn Nervenzellen noch keine Synapsen bilden, war unbekannt.
Ein internationales Forscherteam hat den Teneurin-Latrophilin Proteinkomplexe nun einer hochauflösenden Röntgenstrukturanalyse unterzogen und mehr über seine Funktionen in der frühen Gehirnentwicklung herausgefunden.
Die Strukturanalysen und darauf aufbauende Simulation der FLRT-Bindung ermöglichte es den Forschern, die Bindungsstellen der drei Proteine untereinander zu identifizieren. Durch Einbringen minimaler Veränderungen konnten sie diese Bindungsstellen unterbrechen – woraufhin sich das Wanderverhalten der embryonalen Nervenzellen im Gehirn von Mäusen veränderte.
Während der Gehirnentwicklung wandern embryonale Nervenzellen in "ihre" Bereiche des Gehirns. Dabei werden sie, wie die Untersuchungen jetzt zeigten, von den drei Proteinen zu ihrem Zielort gelenkt. „Dies geschieht erstaunlicherweise nicht durch Anziehung, wie bei der Synapsenbildung, sondern durch Abstoßung der Zellen“, berichtet Rüdiger Klein vom Max-Planck-Institut für Neurobiologie. „Diese Funktion war völlig neu und unerwartet“, ergänzt Elena Seiradake von der Universität Oxford.
Embryonale Nervenzellen besitzen oft nur einen Zellkörper und kurze Ausläufer, Neuriten genannt. Wenn Teneurin und FLRT auf diesen Strukturen an Latrophilin binden, stoßen sich die Zellen ab. Die wandernden Zellen verlieren dadurch teilweise ihren Halt und kommen langsamer voran. So gelenkt gelangen sie zum richtigen Zeitpunkt in ihr Zielgebiet, wo sie heranreifen und auch ein langes Axon ausbilden.
Befinden sich Teneurin und FLRT jedoch auf der Axonoberfläche lösen sie keine Abstoßungsreaktion mehr aus, wenn sie mit Latrophilin in Kontakt kommen. Hier und jetzt ziehen die Proteine die Zellen zusammen, induzieren die Synapsenbildung und vermitteln so ultimativ den Aufbau von Netzwerken miteinander kommunizierender Nervenzellen. „Die gleichen Proteine führen somit zu ganz anderen Reaktionen – je nachdem, wo sie sich auf der Zelle befinden“, fasst Elena Seiradake die Ergebnisse zusammen.
„Wir haben jetzt ideale Voraussetzungen um weitere Interaktionen der Proteine während der Gehirnentwicklung zu untersuchen“, erklärt Rüdiger Klein. In ihren vorherigen Studien konnten die Forscher zeigen, dass FLRT über eigene Bindungspartner sowohl das Migrationsverhalten junger Nervenzellen als auch das Ausbilden der Falten in der Hirnoberfläche beeinflusst. „Da ist es natürlich spannend zu sehen, ob und wie Teneurin und Latrophilin da mitmischen“, so Klein.
KONTAKT
Dr. Stefanie Merker
Presse- und Öffentlichkeitsarbeit
E-Mail: merker@neuro.mpg.de
Tel.: 089 8578 3514
Originalpublikation:
Structural basis of Teneurin-Latrophilin interaction in repulsive guidance of migrating neurons
Daniel del Toro*, Maria A. Carrasquero-Ordaz*, Amy Chu, Tobias Ruff*, Meriam Shahin, Verity A. Jackson, Matthieu Chavent, Miguel Berbeira-Santana, Goenuel Seyit-Bremer, Sara Brignani, Rainer Kaufmann, Edward Lowe, Rüdiger Klein#, Elena Seiradake# (*equal contribution, #corresponding authors)
Cell, 23. Januar 2019 DOI: https://doi.org/10.1016/j.cell.2019.12.014
Weitere Informationen:
http://www.neuro.mpg.de/news/2020-01-klein/de - Die Meldung mit weiteren Informationen
Ähnliche Pressemitteilungen im idw