Mit einem Zell-Katalog durchs visuelle Nadelöhr
Retinale Ganglienzellen (RGCs) sind das Nadelöhr, durch das alle Eindrücke des Sehens auf ihrem Weg von der Netzhaut zum Gehirn fließen. Ein Team des Max-Planck-Instituts für Neurobiologie, der University of California Berkeley und der Harvard University haben einen molekularen Katalog erstellt, der die unterschiedlichen Typen dieser Nervenzellen beschreibt. So können einzelne RGC-Typen systematisch untersucht und mit einer spezifischen Verbindung, Funktion und Verhaltensantwort verknüpft werden.
Ein Zebrafisch sieht Licht und schwimmt darauf zu. Dasselbe passiert bei einem Beutetier, auch wenn die Signale ganz andere sind. Bei einem Fressfeind nimmt der Fisch dagegen Reißaus. Eine Verwechslung hätte ja auch fatale Folgen. Doch wie schafft es das Gehirn, auf einen optischen Reiz mit dem richtigen Verhalten zu reagieren?
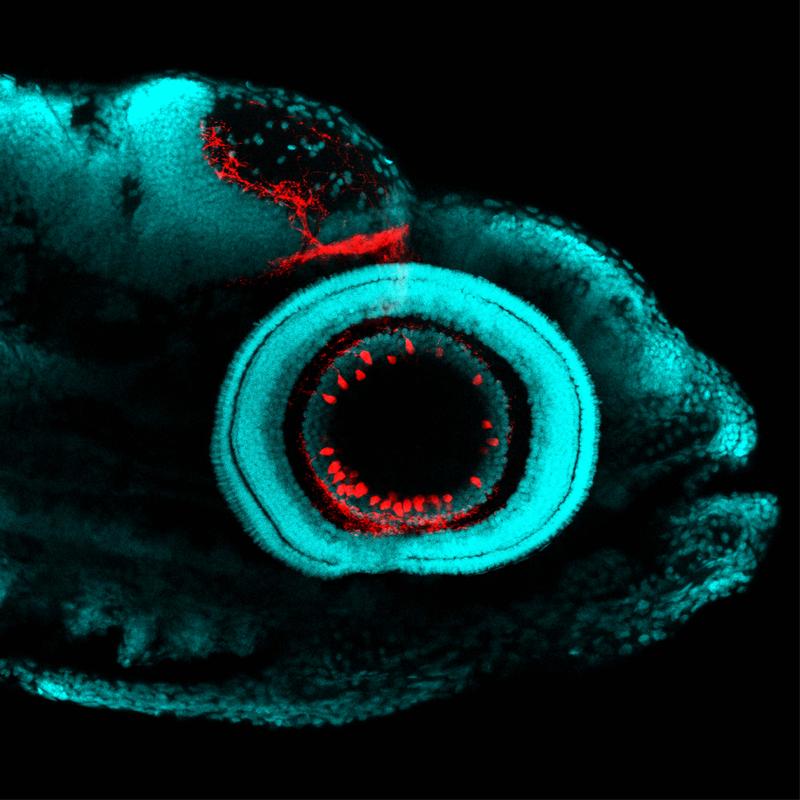
Alle optischen Eindrücke prasseln zunächst auf die Netzhaut (Retina) des Auges ein. Sie hat die Aufgabe, die Eindrücke zu sammeln, aufzubereiten und ans Gehirn weiterzuleiten. Dabei konzentriert sich die Netzhaut auf die wichtigen Details: Gibt es Kontrast und Farbe? Gibt es kleine oder große Objekte? Bewegt sich etwas? Sobald diese Details herausgefiltert sind, werden sie einzeln über retinale Ganglienzellen (RGCs) ans Gehirn weitergeleitet und dort in spezifisches Verhalten übersetzt.
RGCs sind die einzige Verbindung zwischen Netzhaut und Gehirn und spielen somit eine zentrale Rolle im visuellen System. Es gibt eine Vielzahl an RGC-Typen, die unterschiedliche Details zu unterschiedlichen Regionen im Gehirn senden. Allerdings war bisher unklar, wie sich RGC-Typen auf molekularer Ebene unterscheiden, was ihre jeweilige Funktion ist und wie sie helfen, situationsbedingtes Verhalten zu regulieren.
Um diese Rätsel zu entschlüsseln, analysierte ein Team um Yvonne Kölsch aus Herwig Baiers Abteilung die genetische Vielfalt der RGCs. Zusammen mit den Forschungsgruppen von Joshua Sanes (Harvard University) und Karthik Shekhar (UC Berkeley) bestimmten sie das Transkriptom – also die Muster aller aktiven Gene – in RGCs und ordneten jeder Zelle ihren ganz eigenen molekularen Fingerabdruck zu. Anhand von Ähnlichkeiten identifizierte eine Computer-Analyse daraufhin in der riesigen Datenmenge aus über 30.000 RGCs mindestens 32 verschiedene RGC-Typen.
In dem neuen Katalog an Nervenzelltypen fanden die Wissenschaftler Gene, die nur in bestimmten RGC-Typen aktiv sind. Mit Hilfe dieser Gene und gezielter Genom-Editierung erhielten sie zu ausgewählten RGC-Typen genetischen Zugang – die Voraussetzung, deren Struktur und Funktion zu untersuchen.
Im fast durchsichtigen Zebrafisch wurde es so möglich, RGC-Typen farblich zu markieren und zu sehen, in welche Gehirnregionen sie ihre axonalen Zellausläufer schicken. Auch ließ sich bestimmen, welche visuellen Details ein RGC-Typ bevorzugt. Dazu zeigten die Forscher den Fischlarven verschiedene visuelle Reize und untersuchten welcher Reiz einen bestimmten Zelltyp aktiviert. Ein RGC-Typ reagierte zum Beispiel auf Licht, jedoch nicht wenn ein Fressfeind vorgetäuscht wurde.
Doch was bedeutet es für das Verhalten des Fisches, wenn dieser Zelltyp nicht mehr funktioniert? Normalerweise bevorzugen Fischlarven ein helles Umfeld, in dem sie ihre Umgebung gut wahrnehmen und leicht Futter finden können. Inaktivierten die Wissenschaftler den oben beschriebenen Zelltyp, der Lichtverhältnisse misst, verlor der Fisch seine Fähigkeit, in das begünstigte Umfeld zu navigieren – ein deutliches Zeichen dafür, dass dieser RGC-Typ speziell für das Annähern an Licht wichtig ist.
Diese Analyse verknüpft einen molekular beschriebenen RGC-Typ mit einer bestimmten Struktur, Funktion und Verhaltensantwort. Außerdem zeigt es, wie spezialisiert die einzelnen RGC-Typen sind – von den kontaktierten Gehirnregionen bis hin zu ihrer Rolle beim Verhalten. Das untermauert die Theorie, dass hochspezialisierte Nervenzell-Schaltkreise das Erfolgsgeheimnis des Gehirns sind, um die unzähligen optischen Reize in das richtige Verhalten zu übersetzen.
Mit dem molekularen Nervenzellkatalog lassen sich zukünftig weitere RGC-Typen systematisch untersuchen. Die Studie bringt uns somit einen entscheidenden Schritt weiter, ein allumfängliches Verständnis für die funktionelle Architektur des visuellen Systems zu gewinnen.
KONTAKT
Dr. Christina Bielmeier
Presse- und Öffentlichkeitsarbeit
Max-Planck-Institut für Neurobiologie, Martinsried
Tel.: 089 8578 - 3601
E-Mail: bielmeier@neuro.mpg.de
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Herwig Baier
Abteilung Gene – Schaltkreise – Verhalten
Max-Planck-Institut für Neurobiologie, Martinsried
Email: hbaier@neuro.mpg.de
Originalpublikation:
Yvonne Kölsch, Joshua Hahn, Anna Sappington, Manuel Stemmer, António M. Fernandes, Thomas O. Helmbrecht, Shriya Lele, Salwan Butrus, Eva Laurell, Irene Arnold-Ammer, Karthik Shekhar, Joshua R. Sanes and Herwig Baier
Molecular classification of zebrafish retinal ganglion cells links genes to cell types to behavior
Neuron, 23.12.2020
DOI: 10.1016/j.neuron.2020.12.003
Weitere Informationen:
http://www.neuro.mpg.de/news/2020-12-baier/de - Weitere Bilder und ein Video zur Studie
http://www.neuro.mpg.de/baier/de - Webseite der Abteilung von Prof. Herwig Baier
Ähnliche Pressemitteilungen im idw