Protein CAP1 leitet Nervenzellen beim Wachsen
Ohne Gerüstbau keine Hirnentwicklung: Fallen in Nervenzellen diejenigen Proteine aus, die den Aufbau des Zellskeletts steuern, so kommt es zu Schäden im wachsenden Hirn. Das hat eine Forschungsgruppe aus den Lebenswissenschaften herausgefunden, indem es ein Protein untersuchte, das die Nervenzellen bei ihrer Verschaltung leitet. Das Team um den Neurobiologen Professor Dr. Marco Rust von der Philipps-Universität Marburg berichtet im Fachblatt „Progress in Neurobiology“ über seine Ergebnisse.
Damit das Gehirn arbeiten kann, müssen sich seine Nervenzellen miteinander verschalteten. „Für die Vernetzung von Nervenzellen sind ihre langgestreckten Fortsätze wichtig, die so genannten Axone“, erläutert Marco Rust, der Leitautor der Studie. Wachstumskegel an den Enden der auswachsenden Axone suchen die Umgebung nach Signalen ab. „Diese Signale wirken entweder anziehend oder abstoßend“, führt Rust aus. „Sie werden von den Wachstumskegeln erkannt und genutzt, um Axone durch das sich entwickelnde Gehirn zu navigieren und ihre Zielzelle zu finden.“
„Für das Aufspüren dieser Signalmoleküle bilden Wachstumskegel mikroskopisch kleine, dynamische Zellfortsätze aus. Diese Fortsätze enthalten das Gerüstmolekül Aktin in hoher Konzentration“, ergänzt Rusts Mitarbeiter Felix Schneider, der maßgeblich an der Publikation beteiligt ist. „Aktin-Moleküle lagern sich nämlich zu langgestreckten Filamenten zusammen, die das Gerüst dieser Zellfortsätze bilden. Die Ausbildung der Aktin-Filamente wird durch Signalmoleküle aus der Umgebung kontrolliert und von Aktin-Regulatoren in der Zelle umgesetzt.“
In den Wachstumskegeln findet man daher nicht nur Aktin, sondern auch Aktin-Regulatoren wie das Protein CAP1 in großer Menge, stellte Rusts Team fest. „Unsere Ergebnisse zeigen, dass CAP1 die Ausbildung der Zellfortsätze und somit die Funktion der Wachstumskegel kontrolliert“, legt der Neurobiologe dar. „Wir fanden außerdem heraus, dass CAP1 mit einem weiteren Molekül zusammenwirkt, das für die Steuerung von Aktin essentiell ist, nämlich Cofilin1.“ Wie die Forschungsgruppe nachweist, hängt die Funktion des einen Proteins von dem anderen ab und umgekehrt.
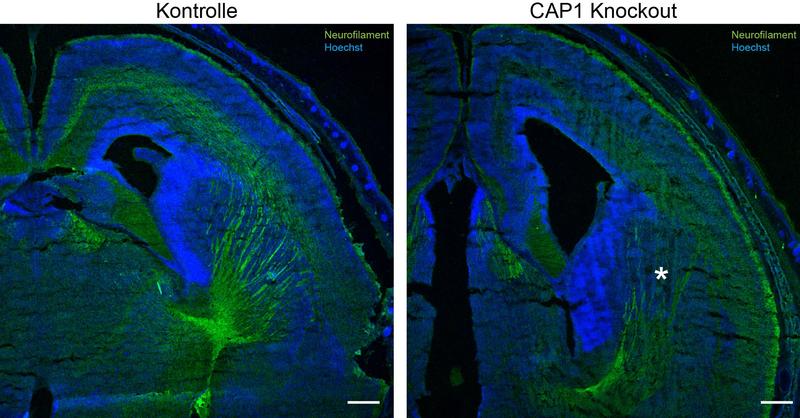
„Experimente an Versuchstieren erbrachten darüber hinaus, dass sich das wachsende Gehirn nicht normal entwickelt, wenn CAP1 fehlt“, erklärt Rust. „Ohne das Protein werden Nervenbahnen während der embryonalen Hirnentwicklung nicht ausgebildet.“
„Alles in allem haben unsere Untersuchungen erwiesen, dass CAP1 die Aktingerüste in Wachstumskegeln kontrolliert“, fasst der Hochschullehrer zusammen. „Dies beeinflusst wiederum die Verschaltung der Neuronen.“
Professor Dr. Marco Rust leitet die Arbeitsgruppe Molekulare Neurobiologie am Institut für Physiologische Chemie des Marburger Fachbereichs Medizin. Er amtiert als stellvertretender Sprecher des Marburger Graduiertenkollegs 2213 der Deutschen Forschungsgemeinschaft zu „Membrane Plasticity in Tissue Development and Remodeling“ und gehört dem neurowissenschaftlichen Forschungszentrum CMBB an.
Neben Forscherinnen und Forschern aus Rusts Arbeitsgruppe und aus dem Marburger Max-Planck-Institut für terrestrische Mikrobiologie beteiligte sich der Genetiker Christian Hübner vom Universitätsklinikum Jena an den Untersuchungen, die der Veröffentlichung zugrunde liegen. Die Deutsche Forschungsgemeinschaft sowie die italienische Stiftung Fondazione Cariplo unterstützten die Forschungsarbeiten finanziell.
Originalveröffentlichung: Felix Schneider & al.: Mutual functional dependence of cyclase-associated protein 1 (CAP1) and cofilin1 in neuronal actin dynamics and growth cone function, Progress in Neurobiology 2021, URL: www.sciencedirect.com/science/article/pii/S0301008221000642
Weitere Informationen:
Ansprechpartner: Professor Dr. Marco Rust,
AG Molekulare Neurobiologie
Tel.: 06421 28-65020
E-Mail: rust@uni-marburg.de
Homepage: www.uni-marburg.de/de/fb20/bereiche/bpc/physiolchemie/forschung/ag-rust
Ähnliche Pressemitteilungen im idw