Wie reagieren unsere Zellen auf Hunger oder Stress?
Zellen reagieren auf Hunger oder Stress indem sie die Zusammensetzung der Proteine auf der Zelloberfläche verändern. Forschende vom Max-Planck-Institut für Biologie des Alterns in Köln haben jetzt herausgefunden, dass ein Proteinkomplex, mTORC1 genannt, ein zentraler Koordinator dieses Prozesses ist. Diese Erkenntnisse könnten in Zukunft wichtig sein für die Entwicklung von Therapien für Krankheiten, bei denen die Aktivität dieses Proteinkomplexes bekanntermaßen fehlreguliert ist, wie zum Beispiel bei Krebs, neurologischen oder metabolischen Störungen oder im Alter.
Unsere Zellen kommunizieren mit ihrer Umgebung auf eine wechselseitige Weise. Einerseits nehmen sie über Proteine auf ihrer Oberfläche ständig Signale aus ihrer Umgebung auf und geben sie an das Zellinnere weiter. Andererseits senden sie Signale nach außen, indem sie Faktoren freisetzen oder durch Proteine, die auf ihrer Oberfläche sitzen. Obwohl seit Jahrzehnten bekannt ist, dass diese bidirektionale Kommunikation entscheidend für die Zellfunktion ist und bei Krankheiten oft gestört ist, war bisher nicht klar, wie dies in den Zellen tatsächlich funktioniert. Forschende des Max-Planck-Instituts für Biologie des Alterns und der Universität Köln haben nun herausgefunden, dass ein Proteinkomplex, mTORC1 genannt, ein zentraler Koordinator dieses Prozesses ist. Diese Erkenntnisse könnten in Zukunft wichtig sein für die Entwicklung von Therapien für Krankheiten, bei denen die Aktivität dieses Proteinkomplexes bekanntermaßen fehlreguliert ist, wie zum Beispiel bei Krebs, neurologischen oder metabolischen Störungen oder im Alter.
Die Zellen, aus denen unser Körper besteht, senden und empfangen ständig Signale an und von ihrer Umgebung. Auf diese Weise spüren sie, ob sie genügend Nährstoffe, Energie, Sauerstoff und alles andere haben, was sie zum Wachsen und Vermehren brauchen. Wenn Nährstoffe knapp werden oder wenn Zellen anderen stressigen Bedingungen ausgesetzt sind, müssen sie darauf reagieren und sich entsprechend anpassen: Sie ändern, wie sie sich bewegen, wie sie Nährstoffe aufnehmen oder wie sie mit benachbarten Zellen und Oberflächen interagieren. Um dies zu erreichen, müssen Zellen die Menge der Oberflächen- und sekretierten Proteine quantitativ und qualitativ umgestalten, was sie durch die Aktivierung komplexer Frachttransportmechanismen tun.
"Ein Weg, über den Zellen Proteine transportieren oder sezernieren, heißt „Unconventional Protein Secretion“, kurz UPS. Dieser Weg wird bei Stress aktiviert und es wurde bereits gezeigt, dass er Proteine transportiert, die bei Krebs, Entzündungen und Knochenbildung eine wichtige Rolle spielen", erklärt Dr. Julian Nüchel, derzeit Postdoc am Max-Planck-Institut für Biologie des Alterns und Erstautor der Studie. "Wie UPS in gestressten oder ausgehungerten Zellen aktiviert wird, war nicht bekannt. Als wir die Regulation dieses sekretorischen Weges im Detail untersuchten, fanden wir heraus, dass der zelluläre Sensor mTORC1 diesen Prozess steuert." Der Proteinkomplex mTORC1 fungiert als wichtigster Sensor der Zelle und verknüpft Signale wie Energie- und Ernährungszustand mit fast allen grundlegenden zellulären Aktivitäten.
Zellulärer Stress verändert die Proteine an der Zelloberfläche
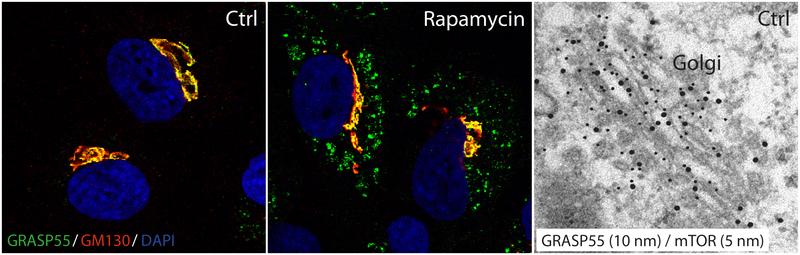
In ihren Experimenten zeigten die Kölner Forschenden, dass verschiedene zelluläre Stressfaktoren, wie zum Beispiel Nährstoffmangel, den Proteinkomplex mTORC1 inaktivieren und den UPS-Transportweg einschalten. "Unter normalen Bedingungen ist mTORC1 aktiv und fügt bestimmten Proteinen eine kleine chemische Modifikation, die sogenannte Phosphorylierung, hinzu und verändert so deren Aktivität oder Lokalisation innerhalb der Zelle", erklärt Forschungsgruppenleiter Dr. Constantinos Demetriades. Im Fall der Kölner Studie konnte gezeigt werden, dass mTORC1 die Lokalisation und Funktion eines Proteins namens GRASP55 steuert, das sich normalerweise im Golgi-Apparat, dem Sortierzentrum für Proteinfracht in der Zelle, befindet. "Unter Stressbedingungen, wenn mTORC1 inaktiviert ist, wird GRASP55 nicht mehr im Golgi gehalten und wandert in andere Kompartimente, um UPS zu fördern."
Neben dem Nachweis, wie UPS in Zellen reguliert wird, gelang es den Forschenden auch, die Proteine zu identifizieren, die auf diesen Weg angewiesen sind, um die Zelloberfläche zu erreichen. Sie entdeckten Faktoren, die eine wichtige Rolle bei der Zellbewegzbg und -kommunikation spielen - Prozesse, die bei menschlichen Krankheiten häufig gestört sind. Dr. Demetriades erklärt: "In Zellen, in denen die mTORC1-Aktivität gestört ist, ist auch der UPS-Transportweg fehlreguliert. Daher könnte dieser sekretorische Weg bei mTOR-bedingten Krankheiten, wie zum Beispiel bei „Tuberous Sclerosis Complex“, eine entscheidende Rolle spielen. Zukünftige Studien in dieser Richtung werden notwendig sein, um die Bedeutung von UPS bei Krankheiten und Alterung des Menschen zu erforschen."
Diese Studie war eine Zusammenarbeit zwischen der Gruppe von Dr. Constantinos Demetriades am Max-Planck-Institut für Biologie des Alterns und der Gruppe von Dr. Markus Plomann am Zentrum für Biochemie der Universität zu Köln, unterstützt von Dr. Beate Eckes vom Labor für Translationale Matrixbiologie der Universität zu Köln sowie Forschern des CECAD Exzellenzclusters für Alternsforschung der Universität zu Köln und Colzyx AB aus Schweden. Das Projekt wurde durch den Europäischen Forschungsrat (ERC), die Deutsche Forschungsgemeinschaft (DFG) und die Max-Planck-Gesellschaft (MPG) gefördert.
Wissenschaftlicher Ansprechpartner:
Dr. Constantinos Demetriades, Demetriades(at)age.mpg.de
Originalpublikation:
Julian Nüchel, Marina Tauber, Janica L Nolte, Matthias Mörgelin, Clara Türk, Beate Eckes, Constantinos Demetriades, Markus Plomann
An mTORC1-GRASP55 signaling axis controls unconventional secretion to reshape the extracellular proteome upon stress
Mol Cell, Juli 2021
Weitere Informationen:
http://pubmed.ncbi.nlm.nih.gov/34245671/ Link zur Originalveröffentlichung
http://www.age.mpg.de
Die semantisch ähnlichsten Pressemitteilungen im idw