Stammzellen organisieren sich selbsttätig zum Embryoid
Forschende der Universität Bonn haben ein Verfahren entwickelt, um aus Stammzellen von Mäusen Embryo-ähnliche Zellkomplexe zu erzeugen. Die Methode ermöglicht neue Einblicke in die Embryonalentwicklung. Mittelfristig könnten sich mit ihr zudem Tests für möglicherweise fruchtschädigende Substanzen entwickeln lassen. Die Studie ist in der renommierten Fachzeitschrift Nature Communications erschienen.
Wie aus einer befruchteten Eizelle eine Maus, ein Hund oder ein Mensch entsteht, ist bis heute nicht vollständig verstanden. Denn die Eizelle hat die Fähigkeit, jeden Gewebetyp im Organismus zu bilden, egal ob Knochen, Haut, Muskulatur oder das Gehirn. Ihre Tochterzellen sind genetisch mit ihr identisch; im Prinzip sollten sie das also auch können. Doch in ihnen werden sehr früh bestimmte Programme im Erbgut aktiviert, die ihren Werdegang unabänderlich festlegen.
Dieser Prozess muss bis ins Feinste koordiniert ablaufen. Denn nur dann ist sichergestellt, dass sich an der passenden Stelle des Gesichts die Augen bilden, während sich andere Zellen ganz in der Nähe zum Nasenknorpel differenzieren. Erstaunlicherweise gibt es aber keinen Dirigenten, der dabei den Taktstock schwingt. „Die Entwicklung des Embryos beruht größtenteils auf Selbstorganisation“, erklärt Prof. Dr. Hubert Schorle vom Institut für Pathologie der Universität Bonn. „Jede Zelle gibt Botenstoffe in ihre Umgebung ab und bestimmt damit das Schicksal ihrer Nachbarn mit.“ Es ist, als würde in einem Orchester jeder nur darauf achten, was die Musikerinnen und Musiker um ihn herum gerade spielen. Und dennoch würde daraus keine Kakophonie entstehen, sondern Beethovens Neunte.
Modifizierte Zelllinien organisieren sich selbsttätig
Die aktuelle Studie erlaubt neue Einblicke in diese genau abgestimmten Vorgänge. Den Bonner Forschenden ist es darin gelungen, embryonale Stammzellen (ES-Zellen) von Mäusen zu einem sogenannten Embryoid heranreifen zu lassen. ES-Zellen sind pluripotent; aus ihnen können sich verschiedene Gewebetypen bilden. Im Gegensatz zu den omnipotenten befruchteten Eizellen sind sie aber keine Alleskönner - ihnen steht also nicht mehr jede Karriere offen. „Aus der Eizelle gehen neben dem eigentlichen Embryo auch noch die Membran, die ihn umgibt, sowie Teile der Plazenta hervor“, erläutert Schorle. „ES-Zellen können diese Gewebestrukturen außerhalb des Embryos dagegen nicht bilden.“
Genau sie leisten aber augenscheinlich einen entscheidenden Anteil zur embryonalen Entwicklung: Regt man ES-Zellen zur Teilung an, entsteht aus ihnen lediglich ein undifferenzierter Zellhaufen. „Wir haben in unserer Studie nun einen Teil der ES-Zellen genetisch verändert“, erklärt Schorles Mitarbeiter Jan Langkabel. Er hat zusammen mit Arik Horne aus der Arbeitsgruppe von Prof. Dr. Joachim Schultze am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) und am LIMES-Institut der Universität Bonn die zentralen Experimente in der Studie durchgeführt. „Einige ES-Zellen konnten daraufhin die Membran bilden und andere den embryonalen Anteil der Plazenta.“
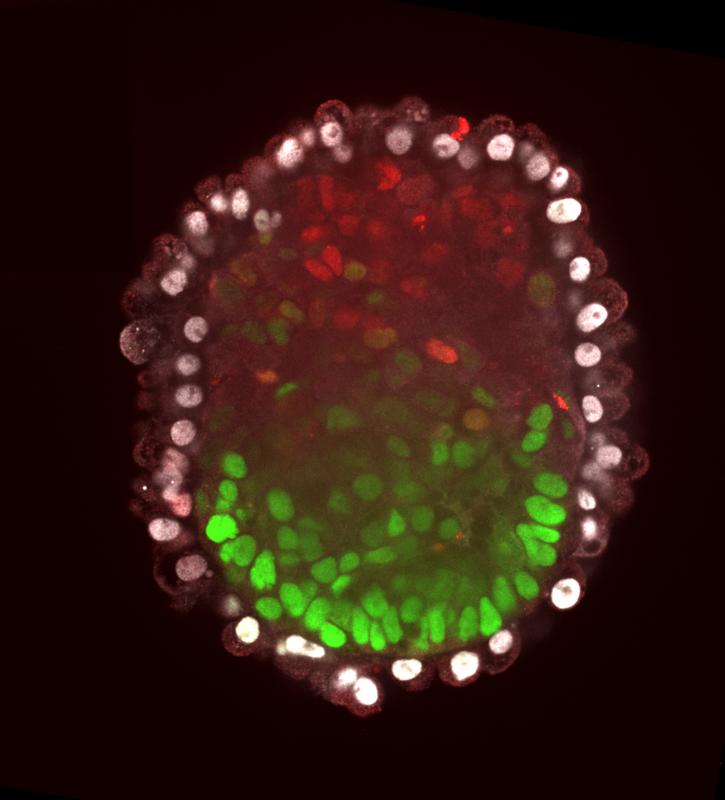
Wenn die Forschenden diese beiden modifizierten Zell-Linien mit den ursprünglichen ES-Zellen zusammenbrachten, beobachteten sie Erstaunliches: Die Mäuse-Zellen differenzierten sich in fein austarierter Weise, so dass schließlich ein Embryo-ähnlicher Komplex entstand - ein Embryoid. „Dieser ähnelte einem 5 Tage alten Mäuse-Embryo“, sagt Horne. „Aus der ungeordneten Mischung der drei Zelltypen hatte sich also eine streng geordnete Struktur entwickelt, ganz ähnlich wie jene, die normalerweise aus einer befruchteten Eizelle entsteht.“ Untersuchungen ihrer Genaktivität bestätigten diesen Befund: Jede einzelne Zelle des Embryoids verhielt sich sehr ähnlich wie ihr Gegenstück in einem wirklichen Embryo.
Embryoide könnten Tierversuche ersetzen
Es war schon zuvor möglich, derartige Embryoide zu erzeugen. Dazu musste man aber drei völlig unterschiedliche Zelllinien verwenden, die zeitlich streng koordiniert separat angezüchtet wurden. Diese Vorgehensweise ist sehr komplex und fehleranfällig - anders als die neue Methode: „Wir arbeiten mit einer einzigen Kultur“, betont Schorle, der ebenso wie Prof. Schultze Mitglied im Transdisziplinären Forschungsbereich (TRA) „Leben und Gesundheit“ der Universität Bonn ist. „Wir schalten dann nach einer bestimmten Zeit bei einem Teil der Zellen das Plazenta-Programm an und bei einem anderen Teil das Membran-Programm. Der Rest ergibt sich dann durch Selbstorganisation quasi von alleine.“
Auf eine ganz analoge Weise plant Prof. Schorle nun, aus ES-Zellen von Affen solche Embryoide zu erzeugen. Diese ließen sich dann für Toxizitäts-Tests einsetzen, meint er - etwa wenn es um die Frage geht, ob bestimmte Substanzen Fehlbildungen im Mutterleib auslösen. Im Moment ist man dabei auf Tierversuche angewiesen. „Der Einsatz solcher Embryoide könnten zumindest einen Teil davon ersetzen“, sagt der Wissenschaftler. Er plant bereits ein entsprechendes Kooperationsprojekt mit Forschenden der Universität Göttingen.
Förderung:
Die Studie wurde durch die Deutsche Forschungsgemeinschaft (DFG) gefördert.
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Hubert Schorle
Institut für Pathologie der Universität Bonn
Tel. +49 228/28716342
E-Mail: schorle@uni-bonn.de
Prof. Dr. Joachim L. Schultze
Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE)
& LIMES-Institut der Universität Bonn
Tel. +49 228/43302410
E-Mail: Joachim.Schultze@dzne.de
Originalpublikation:
Jan Langkabel, Arik Horne, Lorenzo Bonaguro, Lisa Holsten, Tatiana Hesse, Alexej Knaus, Yannick Riedel, Matthias Becker, Kristian Händler, Tarek Elmzzahi, Kevin Bassler, Nico Reusch, Leon Harootoonovtch Yeghiazarian, Tal Pecht, Adem Saglam, Thomas Ulas, Anna C. Aschenbrenner, Franziska Kaiser, Caroline Kubaczka, Joachim L. Schultze und Hubert Schorle: Induction of Rosette-to-Lumen stage embryoids using reprogramming paradigms in ESCs; Nature Communications, DOI: 10.1038/s41467-021-27586-w
Ähnliche Pressemitteilungen im idw