Neue Strategien für verbesserte Antikörpertherapien gegen Leukämie
T-Zell rekrutierende, bispezifische Antikörper (biAb) sind eine vielversprechende Behandlungsstrategie für Patienten* mit bösartigen Tumoren. Der Wirkmechanismus dieser biAb basiert darauf, Zellen der Immunabwehr in engen Kontakt mit Krebszellen zu bringen, sodass die Krebszellen durch die eigenen Immunzellen eliminiert werden. Die Anwendung dieser erfolgreichen Therapieplattform ist jedoch mit Hürden verbunden. Forschende um Marion Subklewe vom LMU Klinikum konnten nun neue Mechanismen entschlüsseln, die zum Erfolg von biAb- Therapien bei Akuten Leukämien beitragen. Das Projekt wurde von der Wilhelm Sander-Stiftung gefördert und in der renommierten Fachzeitschrift Blood veröffentlicht.
Akute Leukämien entstehen durch ein unkontrolliertes Wachstum von Vorläuferzellen der Immunabwehr und werden unterteilt in die akute lymphatische Leukämie (ALL), welche vor allem im Kindesalter auftritt, und die akute myeloische Leukämie (AML), welche dagegen verstärkt im höheren Lebensalter vorkommt. ALL und AML unterscheiden sich dabei im Typ der Vorläuferzellen, die die Erkrankung hervorrufen. Zur Behandlung wird eine intensive Chemotherapie angewendet, um das unkontrollierte Zellwachstum zu stoppen und die Erkrankung somit in den meisten Fällen erfolgreich zu behandeln. Allerdings besteht das Risiko des Wiederauftretens der Erkrankung nach Abschluss der Therapie, sodass bei Patienten mit einem hohen Rückfallrisiko eine allogene Stammzelltransplantation empfohlen wird. Allerdings ist für viele Patienten eine Stammzelltransplantation aufgrund von Alter und Begleiterkrankungen nicht möglich, sodass Komplikationen im Rahmen der Chemotherapie und Rückfälle nach Abschluss der Therapie zu der immer noch zu hohen Todesrate von akuten Leukämien beitragen.
Forschende suchen daher nach neuen Therapiemöglichkeiten, wobei große Hoffnungen in die Immuntherapie mit T-Zell rekrutierenden, bispezifischen Antikörpern (biAb) gesetzt werden. T-Zellen sind Teil der erworbenen Immunantwort und spielen eine zentrale Rolle im Kampf gegen Krankheitserreger, indem sie u.a. infizierte körpereigene Zellen abtöten. biAb machen sich diese Eigenschaft zunutze, indem sie gleichzeitig ein bestimmtes Oberflächenmolekül (CD3 genannt) der T-Zelle und ein charakteristisches Oberflächenmolekül auf der Tumorzelle binden. Dieses führt zu einer Aktivierung der T-Zelle, die die Tumorzelle abtötet. Die Aktivierung und Regulierung der T-Zelle wird durch zusätzliche begleitende Signale moduliert, welche zum Teil auch von Tumorzellen geliefert werden können. Die Arbeitsgruppe von Marion Subklewe hat sich daher drei Fragestellungen gewidmet.
i) die Identifizierung von neuen Zielstrukturen und die Möglichkeit mit biAb intrazelluläre Antigene zu nützen,
ii) die Modulation von biAb-induzierten T-Zellantworten durch das Vorhandensein von kostimulatorischen und koinhibitorischen Signalen auf Tumorzellen und
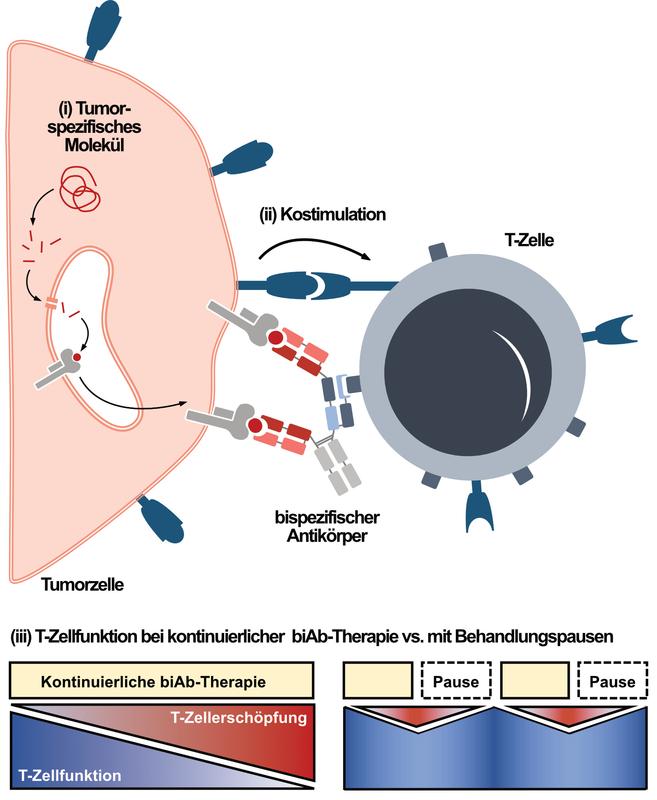
iii) die Rolle der kontinuierlichen biAb Exposition auf die T-Zellfunktion und der daraus veränderten Effektivität in der Lyse von Leukämiezellen (Abbildung 1).
Tumor-spezifische Moleküle aus dem Inneren der Zelle nach außen krempeln
biAb-Therapien nutzten als Ziel bislang nur Moleküle auf der Tumorzelloberfläche, welche aber häufig auch auf gesunden Zellen vorkommen. Mit neuen biAb ist es nun möglich, Bruchstücke von Molekülen aus dem Zellinneren zu erkennen, die durch spezielle Rezeptoren auf der Zelloberfläche präsentiert werden. Dies eröffnet ein großes neues Repertoire an Zielmolekülen für biAb-Therapien und kann deren Spezifität gegen Tumorzellen stark erhöhen. Ein neuer Antikörper zeigte im Labor vielversprechende Ergebnisse und wird nun als erster Vertreter dieser Antikörperklasse in einer klinischen Studie zur Behandlung der AML erprobt. (Referenz: Augsberger, Hänel et al, Blood 2021)
Kostimulatorische Moleküle leisten einen wichtigen Beitrag zur Wirkung von biAb-Therapien
Für eine optimale Aktivierung von T-Zellen, sind sogenannte kostimulatorische (T-Zell aktivierende) Moleküle essenziell, die auf der Oberfläche von Zielzellen (auch Tumorzellen) vorhanden sind. Kommt die T-Zelle durch einen biAb in engen Kontakt mit einer Tumorzelle, verstärken die kostimulatorischen Moleküle die T-Zell Aktivierung und führen so zu einer verbesserten Eliminierung der Tumorzellen. Die Arbeitsgruppe von Frau Subklewe zeigte in einem Modellsystem, dass Tumorzellen mit zusätzlichen kostimulatorischen Molekülen besser durch biAb abgetötet werden. War dagegen zusätzlich auch ein koinhibitorisches (T-Zell hemmemdes) Molekül vorhanden, reduzierte sich die Wirkung der biAb.
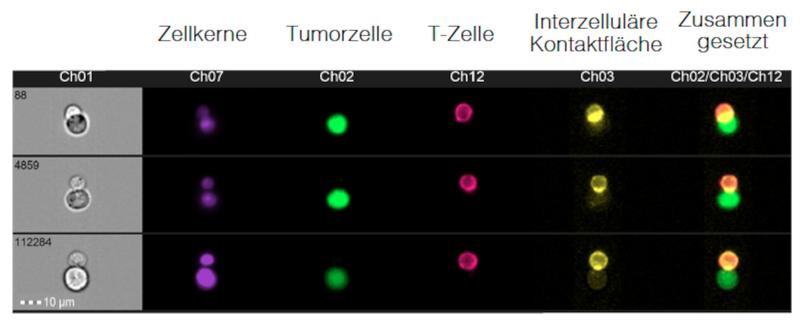
In einer detaillierteren Betrachtung wurde beobachtet, dass kostimulatorische Moleküle auf Tumorzellen die nachgeschalteten Signalwege in T-Zellen beeinflussen. Für die Wirkung von biAb-Therapien ist zudem die Konjugatbildung (direkter Zell-Zell Kontakt) zwischen Target- und Effektorzelle wichtig: Mithilfe von Imaging Flow Cytometry zeigte sich, dass die Konjugatbildung durch kostimulatorische Antigene beeinflusst wird (siehe Abbildung 2). Die Expression von kostimulatorischen Molekülen erhöhte dabei signifikant die Konjugatbildung, verglichen mit Zellen ohne kostimulatorische Moleküle oder Zellen mit koinhibitorischen Molekülen. Zusammenfassend stützen diese Daten die Hypothese, dass die Wirksamkeit von biAb-Therapien, durch kostimulatorische und koinhibitorische Moleküle beeinflusst wird. Für die klinische Anwendung könnte das bedeuten, dass der Antikörper je nach Vorhandensein von kostimulatorischen und -inhibitorischen Molekülen auf den Tumorzellen als Monotherapie oder in Kombination mit weiteren immunmodulatorischen Substanzen gegeben wird, um koinhibitorische Signale zu überwinden und positive kostimulatorische Moleküle zu ergänzen, z.B. durch die Gabe eines kostimulatorischen Antikörpers, oder eines kostimulatorischen Moleküls wie Lenalidomid. Letztes konnte in der Kulturschule die T-Zellantwort signifikant steigern. (Referenz: Marcinek et al, ASH 2021, Hänel et al, ASH 2021).
Behandlungspausen könnten die Wirksamkeit von biAb-Therapien verbessern
Eine weitere Verbesserung von biAb-Therapien könnte zudem durch eine veränderte zeitliche Gabe der biAb erreicht werden: In Anlehnung an die klinische Anwendung, bei der biAb als kontinuierliche Infusion über vier Wochen verabreicht werden, konnte in in-vitro-Modellsystemen gezeigt werden, dass die kontinuierliche biAb-Stimulation im Kontext von AML und ALL zur T-Zell-Erschöpfung führt, wie sie auch bei chronischen viralen Infektionen wie HIV beobachtet wird. Die T-Zellen konnten dabei im Versuch nach längerer Stimulation, Tumorzellen nicht mehr so effektiv eliminieren und schütteten weniger Botenstoffe aus, die für eine effektive Immunantwort wichtig sind. Wurde dagegen die Stimulation mit biAb zeitweise unterbrochen, ähnelten die T-Zellen nach der Behandlungspause funktionell wieder behandlungsnaiven T-Zellen. Nach einer erneuten biAb-Stimulation aktivierten die T-Zellen zudem erneut ein Effektorprogramm und waren im Vergleich zu kontinuierlich stimulierten T-Zellen weniger erschöpft. Der positive Effekt durch eine Behandlungspause auf die Anti-Tumoraktivität der T-Zellen konnte zudem in einem von ALL-Patienten-abgeleiteten Mausmodel bestätigt werden. (Referenz: Philipp et al, Blood 2022)
Die vielversprechenden Forschungsergebnisse der Forschungsgruppe am Klinikum der Ludwig-Maximilians-Universität München wurden kürzlich in der renommierten Fachzeitschrift Blood veröffentlicht.
(7.500 Zeichen inkl. Leerzeichen)
* Die in diesem Text verwendeten Genderbegriffe vertreten alle Geschlechtsformen.
Wilhelm Sander-Stiftung: Partner innovativer Krebsforschung
Die Wilhelm Sander-Stiftung hat das Forschungsprojekt mit insgesamt rund 115.000 Euro über 24 Monate unterstützt. Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 270 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz ausbezahlt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen Unternehmers hervor, der 1973 verstorben ist.
Kontakt
Konstanze Adam
Wilhelm Sander-Stiftung
Presse- und Öffentlichkeitsarbeit & Stiftungskommunikation
Tel.: +49 (0) 89 544187-0
E-Mail: adam@sanst.de
LMU Klinikum München
Das LMU Klinikum zählt zu den größten Universitätsklinika in Deutschland und Europa. Jährlich vertrauen 500.000 Patienten der Kompetenz, Fürsorge und dem Engagement unserer 11.000 Mitarbeiterinnen und Mitarbeiter in ca. 50 Fachkliniken, Instituten und Abteilungen.
Herausragende Einrichtungen am LMU Klinikum sind unter anderem das onkologische Spitzenzentrum CCC-M und Bayerns größtes Transplantationszentrum TxM.
Das LMU Klinikum ist als einziges Klinikum an allen Deutschen Zentren der Gesundheitsforschung beteiligt.
Die Medizinische Fakultät und das LMU Klinikum leisten einen maßgeblichen Beitrag zur Exzellenzstrategie der Ludwig-Maximilians-Universität München.
Kontakt
Philipp Kreßirer
Leiter Stabsstelle und Pressesprecher des Vorstands
LMU Klinikum
Stabsstelle Kommunikation und Medien
Pettenkoferstr. 8a
80336 München
Tel.: +49 (0) 89 4400-58070
E-Mail: philipp.kressirer@med.uni-muenchen.de
Wissenschaftlicher Ansprechpartner:
Univ.-Prof. Dr. Marion Subklewe
Medizinische Klinik und Poliklinik III
Klinikum der Universität München
Marchioninistr. 15
81377 München
Tel.: +49 (0) 89 4400-73133
E-Mail: Marion.Subklewe@med.uni-muenchen.de
Originalpublikation:
1. T-cell exhaustion induced by continuous bispecific molecule exposure is ameliorated by tretament-free intervals. Philipp N., Kazerani M., Nicholls A., Vick B., Wulf J., Straub T., Scheurer M., Muth A., Hänel G., Nixdorf D., Sponheimer M., Ohlmeyer M., Lacher S.M., Brauchle B., Marcinek A., Rohrbacher L., Leutbecher A., Rejeski K., Weigert O., von Bergwelt M., Theurich S., Kischel R., Jeremias I., Bücklein V., Subklewe M. Blood, 2022, doi.org/10.1182/blood.2022015956
2. doi: 10.1182/blood.2020010477. JIF: 22.1
3. Blood, 2021; 138 (Supplement 1):513.
4. Blood, 2021; 138 (Supplement 1):1178
Weitere Informationen:
http://www.wilhelm-sander-stiftung.de/
https://www.lmu-klinikum.de/innere-medizin-3/forschung/arbeitsgruppen/16b74c124f0ffe64
http://www.lmu-klinikum.de
Die semantisch ähnlichsten Pressemitteilungen im idw