Ein unbeständiges flockenartiges Netzwerk entsteht
Dresdner Forscherteam entdeckt, wie der Zellkortex, ein feines Netzwerk von Filamenten unterhalb der Zellmembran, durch Tausende von schnelllebigen Proteinkondensaten auf kontrollierte Weise aktiviert wird.
Während der Entwicklung teilen sich die Zellen eines Embryos so lange, bis sich ein voll funktionsfähiger Organismus gebildet hat. Ein Element der Zelle ist während dieses Prozesses besonders wichtig: der Zellkortex. Dieses feine Netzwerk aus Haar-ähnlichen Fadenstrukturen (Aktin) direkt unter der Zellmembran bestimmt maßgeblich die Form der Zelle. Der Zellkortex spielt bei fast allen Zellfunktionen eine wichtige Rolle, insbesondere wenn sie sich bewegt, sich teilt oder ihre Umgebung wahrnimmt. Um seine Funktionen wahrzunehmen muss der Kortex zunächst aus einzelnen Molekülen aufgebaut werden. Ein internationales Forscherteam des Max-Planck-Instituts für molekulare Zellbiologie und Genetik (MPI-CBG) in Dresden, des Max-Planck-Instituts für Physik komplexer Systeme (MPI-PKS) und des Exzellenzclusters Physik des Lebens (PoL) an der TU Dresden untersuchte die Bildung dieses dynamischen Zellkortex im Fadenwurm Caenorhabditis elegans. Das Team fand heraus, dass Tausende von dynamischen und schnelllebigen tröpfchenförmigen Kondensaten aus Aktinfilamenten die Bildung des ersten Kortex steuern, wenn sich eine unbefruchtete Eizelle nach der Befruchtung in einen Embryo entwickelt. Die Ergebnisse dieser Studie helfen zu verstehen, wie subzellulären Strukturen kontrolliert gebildet werden.
Gleich nach der Befruchtung einer Eizelle beginnt sich der Zellkortex zu bilden. Es dauert etwa zehn Minuten, bis dieser vollständig entwickelt ist. Der Kortex besteht aus Aktinfilamenten und Motorproteinen, die in einem dicht verbundenen Netzwerk organisiert sind. Der dynamische Aufbau des Kortex ist das Ergebnis von Motorproteinen, die an Aktinfilamenten ziehen und so mechanische Spannungen Kräfte im Kortex erzeugen. Diese Kräfte bestimmen beispielsweise die Form der Zellen, ihre Fähigkeit, die Umgebung wahrzunehmen und ihre Funktionen in unserem Körper zu erfüllen. Die Dynamik des Zellkortex wurde in der Vergangenheit bereits intensiv untersucht, aber der Mechanismus, durch dieser direkt nach der Befruchtung zum ersten Mal aktiviert wird, war bislang unbekannt. Die Prinzipien, auf denen die Bildung der Zellrinde beruht, sind von entscheidender Bedeutung, da sie an fast allen Funktionen der Zelle beteiligt ist und eine fehlerhafte Organisation des Zellkortex zu einer Beeinträchtigung wichtiger zellulärer und entwicklungsbezogener Prozesse führen kann.
Proteinkondensate leben nur kurz und ermöglichen eine korrekte Entwicklung.
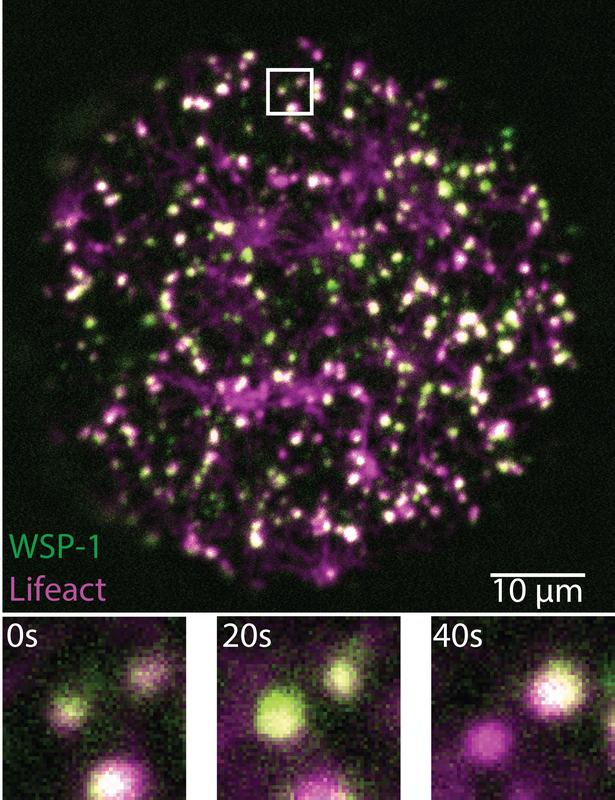
Um zu verstehen, wie der Zellkortex aktiviert wird, untersuchte ein interdisziplinäres Forschungsteam am MPI-CBG, MPI-PKS und PoL diesen Prozess beim Fadenwurm C. elegans. „Wir konnten beobachten, wie sich Aktin und die Proteine WSP-1 und ARP2/3, die den Aktinkern bilden, zu kleinen Kondensaten zusammenfinden, die nur für Sekunden bestehen bleiben, um sich gleich danach wieder aufzulösen. Diese Kondensate sorgen dafür, dass die richtige Menge an Aktinfilamenten in der genau passenden Weise miteinander verbunden ist. Für mich liegt die Schönheit dieser Strukturen darin, was uns ihre Dynamik über die ungewöhnliche Chemie der lebenden Materie lehrt. Die Strukturen bestehen aus weit verzweigten Aktinfilamenten und haben Ähnlichkeit mit einer Schneeflocke, sind aber viel unbeständiger“, erklärt Arjun Narayanan, Forscher in der Gruppe von Stephan Grill, Direktor am MPI-CBG. Victoria Tianjing Yan ergänzt: „Wir haben unsere eigene Bildgebungs- und Bildanalysemethode entwickelt, die wir „Mass Balance Imaging“ nennen, um zu untersuchen, wie die Struktur der schnelllebigen Kondensate wächst und sich weiterentwickelt.“ Während ihrer Studien fanden die Forscherinnen und Forscher heraus, dass bestimmte biochemische Reaktionen steuern, wie schnell ein Kondensat wächst und wann es wieder verschwindet. Kondensate im Zellkortex organisieren ihren eigenen Lebenszyklus weitgehend unabhängig von ihrer äußeren Umgebung.
Stephan Grill fasst zusammen: „Wir schließen daraus, dass die Kondensate im Zellkortex eine neue Art von biomolekularen Kondensaten sind, die durch spezifische biochemische Reaktionen angetrieben werden und sich innerhalb von Sekunden auf- und abbauen.“ Er fügt hinzu: „Wir vermuten, dass diese schnelllebigen Kondensate die Aktivierung des Zellkortex und die feine Präzision seiner wachsenden Architektur nach der Befruchtung Eizelle steuern. Frank Jülicher, Direktor am MPI-PKS und Mitautor der Studie, fügt hinzu: „Diese Studie ist ein weiteres Beispiel dafür, wie wir hier in Dresden eine Brücke zwischen Physik und Biologie schaffen. Unser interaktives Arbeitsumfeld mit Biologen und theoretischen Physikern zusammen ermöglicht neue interdisziplinäre Ansätze, um die Physik biologischer Prozesse zu entschlüsseln.“
Wissenschaftlicher Ansprechpartner:
Prof. Stephan Grill
+49 (0) 351 210 2300
grill@mpi-cbg.de
Originalpublikation:
Victoria Tianjing Yan, Arjun Narayanan, Tina Wiegand, Frank Jülicher,
Stephan W. Grill: “A condensate dynamic instability orchestrates actomyosin cortex activation”, Nature (2022), https://doi.org/10.1038/s41586-022-05084-3
Die semantisch ähnlichsten Pressemitteilungen im idw