Vielversprechender neuer Therapieansatz beim alveolären Rhabdomyosarkom
Das alveoläre Rhabdomyosarkom, ein bösartiger Tumor, der vom Muskelgewebe ausgeht, ist der häufigste Weichteiltumor im Kindesalter. Forschenden um Prof. Dr. Anton Henssen von der Charité Berlin ist es nun gelungen, eine neue Therapiemaßname mit einem Medikament zu identifizieren, das gerade für andere Krebsarten untersucht wird. Es blockiert die DNA-Reparatur und zwingt die Zellen so zum Absterben, denn Krebszellen des alveolären Rhabdomyosarkoms weisen viele DNA-Schäden auf und sind so stärker auf Reparaturprozesse angewiesen als gesunde Zellen. Das Projekt wurde von der Wilhelm Sander-Stiftung gefördert und kürzlich in Nature Communications veröffentlicht.
Rhabdomyosarkome sind maligne Weichteiltumore, die sich vor allem bei Kindern und Jugendlichen aus Zellen des quergestreiften Muskelgewebes entwickeln. Obwohl sie selten sind, stellen sie den zweithäufigsten soliden Tumor im Kindesalter dar. Das alveoläre Rhabdomyosarkom ist eine Unterart des Rhabdomyosarkoms, das durch eine Umlagerung von Chromosomenabschnitten gekennzeichnet ist, bei der eine neue Proteinfusion namens PAX3-FOXO1 entsteht. Alveoläre Rhabdomyosarkome sind die aggressivere Form des Rhabdomyosarkoms, mit einer Gesamtüberlebensrate von 30 % nach fünf Jahren. In Europa werden jedes Jahr schätzungsweise 500 neue Rhabdomyosarkom-Fälle diagnostiziert, davon 100 alveoläre Rhabdomyosarkome. Trotz zahlreicher Fortschritte in der Krebstherapie hat sich die Behandlung des Rhabdomyosarkoms in den letzten vier Jahrzehnten nicht verändert, so dass neue und wirksamere Behandlungen dringend erforderlich sind.
Eine der Herausforderungen bei der Therapie des alveolären Rhabdomyosarkoms ist der Mangel an medikamentös behandelbaren Faktoren Abgesehen von der PAX3-FOXO1-Fusion weisen alveoläre Rhabdomyosarkome nicht viele wiederkehrende genetische Mutationen auf, was die Möglichkeiten zur Verwendung spezifischer Medikamente einschränkt. Zu Nutze machten sich die Forschenden die Tatsache, dass Krebszellen häufig viele DNA-Schäden aufweisen, die die Entstehung neuer Mutationen ermöglichen. Die geschädigte DNA muss repariert werden, bevor sich die Zellen teilen können, damit die Integrität des Genoms erhalten bleibt. In den letzten Jahren wurden zahlreiche Medikamente für verschiedene Krebsarten entwickelt, die die DNA-Reparatur blockieren und so vielversprechende Ergebnisse erwarten lassen.
ATR als therapeutischer Angriffspunkt
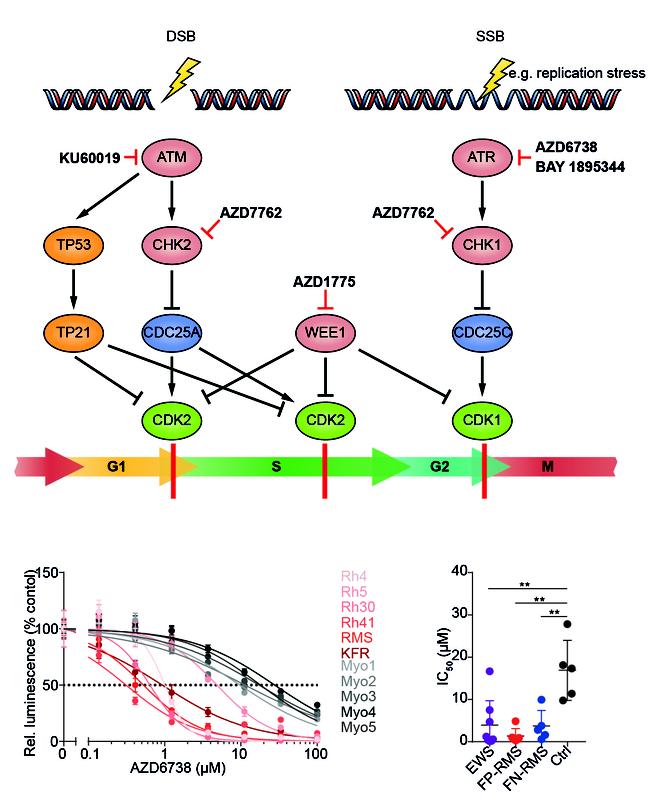
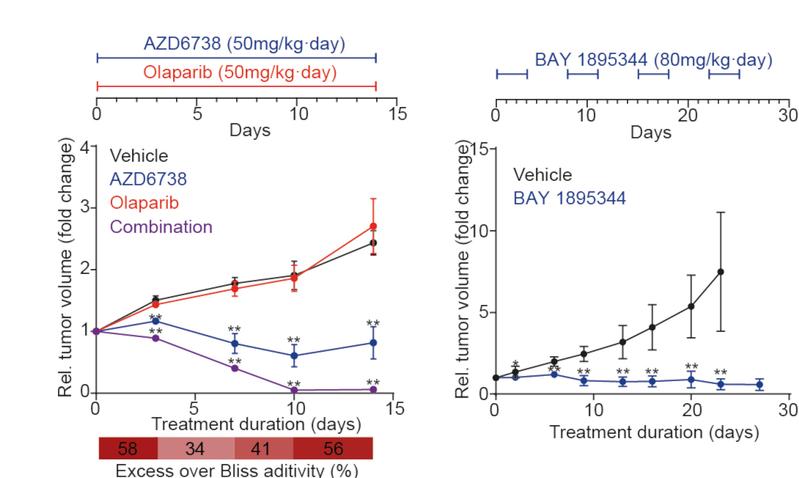
Das Labor von Anton Henssen im Zentrum für Experimentelle und Klinische Forschung der Charité-Universitätsmedizin und des Max-Delbrück-Centrums, beide in Berlin, hat kürzlich gezeigt, dass alveoläre Rhabdomyosarkome empfindlich auf Hemmstoffe reagieren, die auf ein für die DNA-Reparatur wesentliches Protein namens ATR abzielen. Sein Team identifizierte PAX3-FOXO1 als einen Faktor, der die DNA-Schäden in den Krebszellen erhöht und sie damit anfälliger für einen Mangel an DNA-Schadensreparatur macht. Durch die Hemmung von ATR akkumulieren die Zellen DNA-Schäden und werden in den Zellselbstmord, die sogenannte Apoptose, gezwungen. „Als wir das Medikament an entsprechend präparierten Mäusen testeten, stellten wir fest, dass ATR-Inhibitoren eine starke Antitumoraktivität haben, was die Medikamente den Patient:innen einen Schritt näher bringt" erklärt Anton Henssen. Auf der Grundlage dieser Daten werden derzeit in den USA Patient:innen für eine neue klinische Studie gesucht, in der ATR-Inhibitoren bei pädiatrischen soliden Tumoren, einschließlich alveolärem Rhabdomyosarkom, getestet werden sollen.
Da Arzneimittelresistenz häufig der limitierende Faktor in der Krebstherapie ist, begannen die Forschenden mit der Untersuchung von Faktoren, die eine Resistenz gegen die ATR-Hemmung beim alveolären Rhabdomyosarkom verursachen. Mithilfe eines CRISPR-Screens, der auf alle Gene im Genom abzielt, identifizierten sie ein, die Genexpression regulierendes, Protein namens FOSB als Marker für eine Resistenz. Die Gruppe versucht nun, neue Therapien zu finden, die diese Resistenz überwinden könnten, um die Behandlung des alveolären Rhabdomyosarkoms weiter zu verbessern.
„Wir machen uns die Aggressivität der Krebszellen zu nutzen, indem wir sie in was positives verwandeln“ so Anton Henssen. Das Potenzial von ATR-Inhibitoren, allein oder in Kombination mit anderen Arzneimitteln, auch für die derzeitige Behandlung des alveolären Rhabdomyosarkoms, muss in der künftigen Forschung weiter erforscht werden. Diese Studie bietet jedoch einen soliden Ausgangspunkt, von dem Patient:innen in einigen Jahren profitieren könnten.
(4598 Zeichen inkl. Leerzeichen)
*Die in diesem Text verwendeten Genderbegriffe vertreten alle Geschlechtsformen.
Wilhelm Sander-Stiftung: Partnerin innovativer Krebsforschung
Die Wilhelm Sander-Stiftung hat das Forschungsprojekt mit insgesamt knapp 163.000 Euro über 24 Monate unterstützt. Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 270 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz ausbezahlt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen Unternehmers hervor, der 1973 verstorben ist.
Kontakt
Konstanze Adam
Wilhelm Sander-Stiftung
Presse- und Öffentlichkeitsarbeit & Stiftungskommunikation
Tel.: +49 (0) 89 544187-0
E-Mail: adam@sanst.de
Wissenschaftlicher Ansprechpartner:
Prof. Dr. med. Anton G. Henssen
Mildred Scheel Professor and Head of Preclinical Cancer Research
Experimental and Clinical Research Center (ECRC) of the
Max Delbrück Center (MDC) and Charité Berlin
Lindenberger Weg 80
13125 Berlin
Tel.: +49 (0) 450 666118
E-Mail: Anton.Henssen@charite.de
Twitter: @anton_gh
Originalpublikation:
Dorado García, H., Pusch, F., Bei, Y. et al. Therapeutic targeting of ATR in alveolar rhabdomyosarcoma. Nat Commun 13, 4297 (2022). https://doi.org/10.1038/s41467-022-32023-7
Weitere Informationen:
http://www.wilhelm-sander-stiftung.de
https://henssenlab.com/
Ähnliche Pressemitteilungen im idw