Synthetische Zellen zur Interaktion mit lebender Materie
Forschende am DWI – Leibniz-Institut für Interaktive Materialien sind dem Ziel, funktionale synthetische Zellen herzustellen, einen Schritt nähergekommen. Die Arbeitsgruppe untersucht Voraussetzungen für die Entwicklung von Materialien, die mit lebender Materie kommunizieren und fungieren können. Solche Materialien werden beispielsweise verwendet, um antimikrobielle Oberflächen zu entwickeln, die mit Blut in Kontakt kommen. Die Forschung wurde vom ehemaligen Arbeitsgruppenleiter César Rodriguez-Emmenegger am DWI geleitet, der seit neustem Professor am IBEC Barcelona ist. Die neuen Erkenntnisse wurden in den Fachzeitschriften Advanced Materials und Advanced Science veröffentlicht.
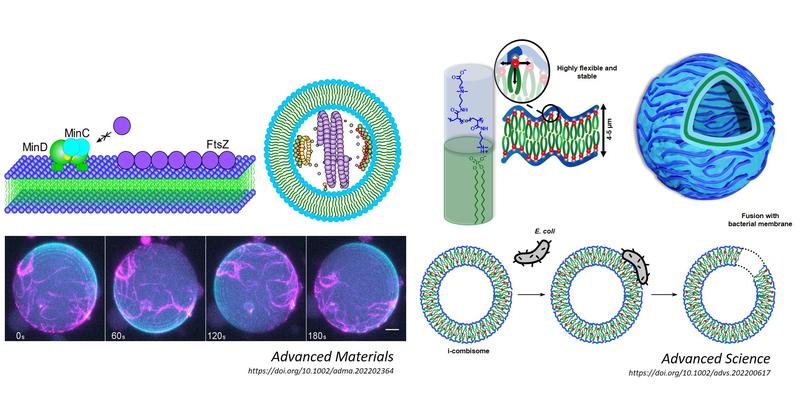
Die Herstellung synthetischer Zellen im Labor, die Verhaltensweisen und Funktionen lebender Zellen imitieren können oder gar übersteigen, ist eine der größten Herausforderungen auf dem Gebiet der bioinspirierten interaktiven Materialien. Zentrale Funktionen biologischen Verhaltens sind beispielsweise der Transport von Molekülen, Stoffwechselfunktionen, Wachstum und im Idealfall Replikation durch Zellteilung. Zellimitationen, die eine oder mehrere dieser Funktionen erfüllen, werden als Protozellen bezeichnet. Sie könnten in Zukunft zur Untersuchung komplexer biologischer Fragen eingesetzt werden, neue Konzepte in der Biomedizin eröffnen und zur Entwicklung neuer Biomaterialien, Therapeutika und medizinischer Geräte beitragen. Eine unabdingbare Voraussetzung für die Entwicklung solcher Protozellen ist die Fähigkeit, funktionelle und aktive Zellkomponenten sowie aktive Zellmaschinerien mit synthetischen Komponenten zu kombinieren. In der Gruppe von César Rodriguez-Emmenegger sind die Wissenschaftlerinnen und Wissenschaftler des DWI diesen Zielen einen Schritt nähergekommen.
In der Veröffentlichung in Advanced Materials stellt das Forscherteam die erfolgreiche Integration einer aktiven Zellteilungsmaschinerie (das sogenannte Divisom) in synthetische Vesikel vor. Ein Divisom besteht aus einem hochkomplexen Proteinsystem, das für die Zellteilung in Bakterien verantwortlich ist, indem es einen Ring in der Mitte der Zelle bildet, der sich dann zusammenzieht und das Bakterium in zwei gleich große Tochterzellen teilt. Damit das Divisom funktioniert, muss es mit der Membran der synthetischen Zelle mit der gleichen Intensität und Dynamik interagieren wie mit natürlichen Membranen, eine Herausforderung, die in der Forschung bisher noch nicht bewältigt werden konnte. Die Forscherinnen und Forscher entwarfen neue makromolekulare Bausteine und programmierten sie so, dass sie sich in der Membran zusammenfügen und mit dem Divisom in einer vorher festgelegten Weise interagieren. Dieser Ansatz ermöglichte es dem Team, das Verhalten des Divisoms in synthetischen Zellen akkurat zu reproduzieren. "Der erste Schritt unseres Forschungsprojekts bestand darin, geeignete synthetische Membranbausteine herzustellen. Wir entschieden uns für eine neue Familie von Janus-Dendrimeren, die sich zu vesikulären Strukturen, den Dendrimersomen, zusammenfügen. Janus-Dendrimere sind Makromoleküle, die aus einem verzweigten Kern und zwei gegenüberliegenden Ästen mit unterschiedlichen funktionellen chemischen Gruppen bestehen. Da wir diese Gruppen selbst bestimmen können, sind wir in der Lage, die Form und die Eigenschaften der Makromoleküle so zu gestalten, dass die Rekonstitution des Divisoms innerhalb des Vesikels möglich ist", erklärt Anna Maria Wagner, Doktorandin und Co-Erstautorin der Publikation.
Bislang war die Rekonstitution von Komplexen wie Zellteilungsmaschinerien auf Anwendungen in Liposomen, natürlichen Vesikeln aus Lipiden, beschränkt. Mit dieser Arbeit beweist das Forscherteam zum ersten Mal, dass diese natürlichen Einheiten in vollsynthetische Dendrimersomen eingebaut werden können, ohne ihre grundlegende Funktionalität zu verlieren. Dies stellt einen bedeutenden Durchbruch für die Konstruktion synthetischer Zellen mit biologischen Komponenten dar, da die Anpassung der Membran-Divisom-Interaktionen ein Schlüsselfaktor für die Entwicklung von emergentem biologischem Verhalten ist.
Darüber hinaus ist das Team von Prof. Rodriguez-Emmenegger daran interessiert, neue synthetische Zellmembran-Imitate zu entwickeln, die in der Lage sind, Aufgaben zu erfüllen, die unter anderem von zellulären Funktionen inspiriert sind. Kürzlich haben sie zusammen mit Prof. Andreas Herrmann, stellvertretender wissenschaftlicher Direktor am DWI, ein solches neuartiges System im Fachjournal Advanced Science veröffentlicht. Darin berichten sie über die Entwicklung von ionisch verbundenen Kamm-Polymeren, die sich in Wasser zu Vesikeln mit biomimetischer Membrandicke selbst zusammenfügen und die sie als ionische Combisome (i-Combisome) bezeichnen.
"Die i-Combisomen sind ein hervorragendes Beispiel dafür, wie durch präzises molekulares Design und gezielte Programmierung der Art und Stärke der molekularen Wechselwirkungen Systeme mit maßgeschneiderten Eigenschaften entwickelt werden können", erklärt Jonas Quandt, Doktorand am DWI. "Unser System kann als makromolekulares Analogon zu Phospholipiden verstanden werden, die die Bausteine der natürlichen Zellmembran sind. Es besteht aus einem hydrophilen Polymergerüst, an das wir über ionische Wechselwirkungen hydrophobe lipidähnliche Anhänge anbringen. Indem wir das Polymergerüst als Anker für die lipidähnlichen Strukturen verwenden, erhöhen wir die Stabilität der i Combisomen im Vergleich zu Liposomen. Eine solche einzigartige molekulare Anordnung ermöglicht Flexibilität und Dynamik wie in natürlichen Membranen."
In ihrer Arbeit konnten die Wissenschaftlerinnen und Wissenschaftler zeigen, dass die einzigartige Membrantopologie zu ähnlichen biophysikalischen Eigenschaften wie die natürlicher Zellmembranen führt und die nahtlose Integration funktioneller Komponenten der natürlichen Membranen ermöglicht. Dazu gehörte die Koassemblierung mit (Glyko-)Lipiden und porenbildenden Peptiden, die den Ionentransport durch die Membran ermöglichen. Darüber hinaus konnten die Forscherinnen und Forscher Bakterien-Combisom-Hybride herstellen, indem sie die Zellperipherie lebender Bakterienzellen in die synthetische Membran einbrachten. Eine derartige Fusion von synthetischen und biologischen Membranen ist völlig neuartig.
Der hohe Grad an Gleichartigkeit der i-Combisomen zu Zellmembranen, die Konfigurierbarkeit der chemischen und biologischen Zusammensetzung der Membran und die Fähigkeit, mit lebender Materie zu fusionieren, könnten zukünftig potenziell zu synthetischen Zellen mit erweiterten Funktionen führen. Diese würden beispielsweise zur Untersuchung komplexer biologischer Fragen oder zur Entwicklung neuer Konzepte in der Biomedizin eingesetzt werden.
Wissenschaftlicher Ansprechpartner:
Prof. Dr. César Rodriguez-Emmenegger (rodriguez@dwi.rwth-aachen.de)
Anna Maria Wagner (awagner@dwi.rwth-aachen.de)
Jonas Quandt (quandt@dwi.rwth-aachen.de)
Originalpublikation:
https://doi.org/10.1002/adma.202202364
https://doi.org/10.1002/advs.202200617
Weitere Informationen:
https://www.dwi.rwth-aachen.de/seite/synthetische-zellen-zur-interaktion-mit-lebender-materie
Ähnliche Pressemitteilungen im idw