Click-Freisetzung von Nitrit
Bioorthogonale Methode zur Einschleusung von Nitrit in Zellen für die Krebstherapie
Ein Forschungsteam hat ein bioorthogonales Molekülsystem entwickelt, das Nitrit-Ionen in Zellen einschleusen kann. In einer „Click-to-Release“-Strategie werden die Ionen in Krebszellen freigesetzt. Dort setzen sie mit anderen Wirkstoffen zusammen zellabtötende Mechanismen in Gang, berichtet das Team in der Zeitschrift Angewandte Chemie. Mit dem System könnten in der Krebstherapie Synergien von verschiedenen Wirkstoffen besser genutzt werden.
Zellen wandeln Nitrit-Ionen in Stickstoffmonoxid (NO) um, das im Körper vielfältige Funktionen hat. Unter anderem kann es durch Bildung von reaktiven Sauerstoffspezies die Wirkung von Krebsmedikamenten verstärken. Allerdings ist es schwierig, Nitrit genau dorthin zu bringen, wo es wirken soll. Die Forschungsgruppen von Fude Feng an der Nanjing University und Shu Wang an der University of the Chinese Academy of Science in Beijing (China) haben nun ein bioorthogonales System entwickelt, das Nitrit-Ionen in Krebszellen gemeinsam mit anderen Wirkstoffen zum Zellorganell des endoplasmatischen Retikulums bringt und dort freisetzt.
Bioorthogonale Systeme ermöglichen chemische Reaktionen (sogenannte Click-Reaktionen), ohne dass es auf dem Weg an den Wirkort Nebenreaktionen gibt. Da sich über diese Bioorthogonalität viele Ansatzpunkte für neue Therapien eröffnen, wurden die Erfinder:innen der Click-Chemie und der bioorthogonalen Chemie dieses Jahr mit dem Nobelpreis für Chemie geehrt.
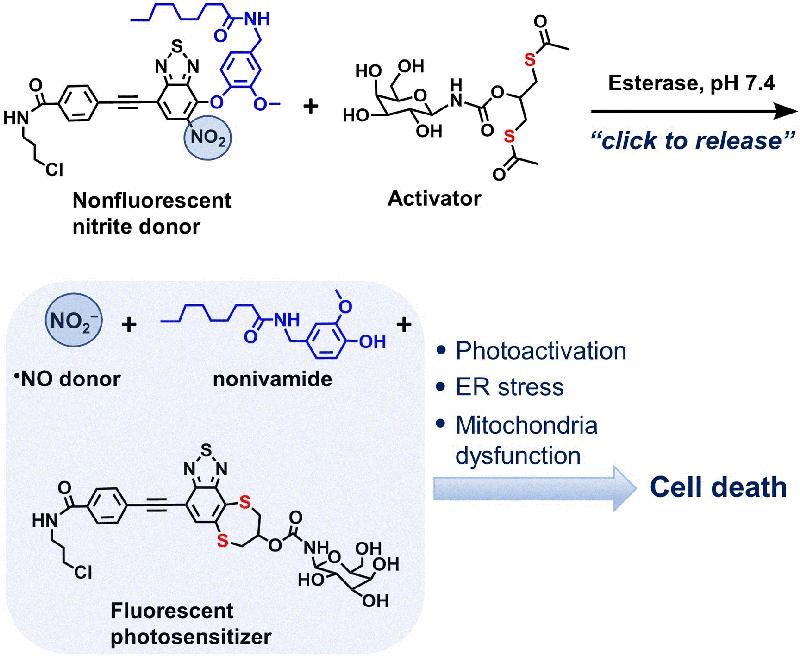
Um Nitrit-Ionen ohne unerwünschte Reaktionen an den Zielort zu bringen, müssen sie als Nitrogruppe an ein Trägermolekül gebunden werden. Allerdings sind die Bedingungen zum Wiederablösen des Nitrits vom Träger zumeist harscher als diejenigen, die in Körperzellen herrschen. Daher gestalteten die Forschenden zwei bioorthogonale Vorstufen: eine, die die Nitrogruppe und weitere Wirkstoffe zum Zielort transportiert, und eine andere zum Freisetzen der Wirkstoffe durch eine „Click-to-Release“-Reaktion.
Die erste der beiden Vorstufen erfüllte mehrere Funktionen: Zum einen wird sie vom endoplasmatischen Retikulum (ER) aufgenommen. In diesem Zellorganell laufen zahlreiche wichtige Zellprozesse ab, und viele Medikamente entfalten hier ihre pharmakologische Aktivität. Zum anderen transportiert sie neben der Nitrogruppe auch den Wirkstoff Novidamid, der in hoher Konzentration Stressreaktionen in der Zelle auslöst und dadurch die Krebszelle in den Zelltod schicken kann.
Die andere molekulare Vorstufe, ein Dithiol, wird von Enzymen aktiviert, die besonders in Krebszellen auftreten. Einmal aktiviert, reagiert das Dithiol mit der ER-Non-Vorstufe und setzt in einer „Click-to-Release“-Reaktion sowohl das Nitrit als auch das Novidamid frei. Und nicht nur das: Das entstandene neue Molekül fluoresziert. Damit wird es zum Phosensibilisator. Unter Lichteinwirkung verstärkt es die Wirkung der Nitrit-Ionen und des Novidamids. Die Methode der Photosensibilisierung wird in der photodynamischen Krebstherapie genutzt.
An Leberkrebszellen getestet, stoppte das bioorthogonale System das Wachstum dieser Zellen. Die Forschenden beobachteten zudem einen starken Anstieg von reaktiven Sauerstoffspezies, nachdem sie das Dithiol und das ER-Non zugegeben hatten. Da keine der bioorthogonalen Komponenten allein diese Wirkung zeigte, folgerte das Team, dass alle Komponenten synergistisch wirken. Damit eröffnen sich neue Möglichkeiten für eine effektivere Krebstherapie.
Angewandte Chemie: Presseinfo 27/2022
Autor/-in: Shu Wang, Institute of Chemistry Chinese Academy of Sciences (China), https://people.ucas.edu.cn/~0000179?language=en
Angewandte Chemie, Postfach 101161, 69451 Weinheim, Germany.
Die "Angewandte Chemie" ist eine Publikation der GDCh.
Originalpublikation:
https://doi.org/10.1002/ange.202213765
Weitere Informationen:
http://presse.angewandte.de
Ähnliche Pressemitteilungen im idw