Inhalations-Anästhetika machen Blut-Hirn- Schranke durchlässiger
In einem erfolgreich abgeschlossenen Förderprojekt der Wilhelm Sander-Stiftung
untersuchten Forschende um Gesine Saher vom Max-Planck-Institut (MPI) für
Multidisziplinäre Naturwissenschaften gemeinsam mit Kolleg:innen aus Freiburg,
Göttingen, Münster und Oldenburg, ob das Inhalations-Anästhestikum Isofluran
einen speziellen Importweg über die Blut-Hirn-Schranke anschaltet. Dies
unterstützt die Chemotherapie von Hirntumoren in Mäusen und könnte zur
Behandlung von vielen Erkrankungen des Nervensystems genutzt werden.
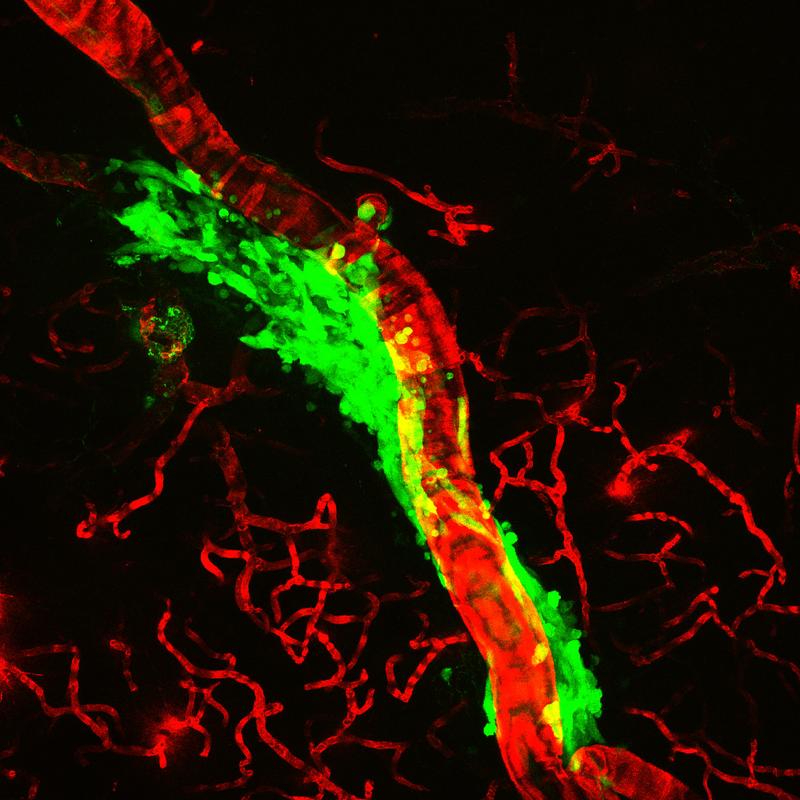
Substanzen gelangen in fast allen Organen nahezu uneingeschränkt durch die Blutgefäße ins Gewebe hinein und wieder hinaus. Nur der Transport ins Gehirn wird stark kontrolliert. Dort verhindert die Blut-Hirn-Schranke, dass körperfremde Stoffe eindringen und unser Gehirn schädigen. Doch es gibt Ausnahmen. Betäubungsmittel können aufgrund ihrer biophysikalischen Eigenschaften die Blut-Hirn-Schranke passieren. Seit Langem wird vermutet, dass Inhalations-Anästhetika, wie beispielsweise Isofluran, auch direkt auf diese Barriere einwirken. Im ausgeklügelten Kontrollsystem der Blut-Hirn-Schranke verhindern feste Verankerungen zwischen den Zellen der Blutgefäße – die sogenannten Endothelzellen – den unkontrollierten Fluss von Molekülen. Zusätzlich zu dieser physikalischen Barriere besitzt die Blut-Hirn-Schranke zahlreiche Transportmechanismen, die benötigte Substanzen wie zum Beispiel Nährstoffe passieren lassen und körperfremde Stoffe umgehend ausschleusen.
Die Blut-Hirn-Schranke gewährleistet so im gesunden Menschen, dass die Nervenzellen optimal funktionieren. In Patient:innen, die an Erkrankungen des Nervensystems wie Hirntumoren leiden, stellt sie allerdings ein Problem dar. Die strikte Zugangskontrolle verhindert, dass Medikamente wie zum Beispiel Chemotherapeutika an ihren Wirkort gelangen. Eine pharmakologische Therapie von Hirntumoren ist daher oft wenig wirksam.
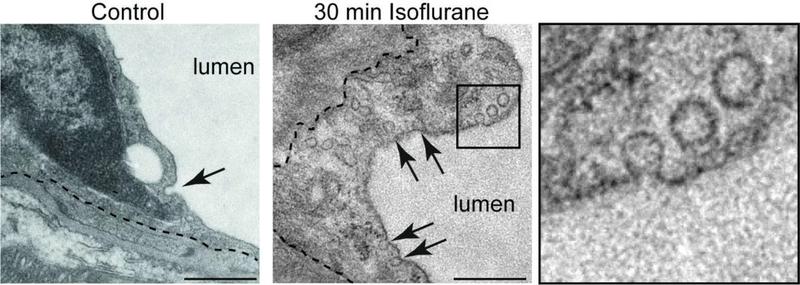
Wie das Forschungsteam um Gesine Saher und ihre Kooperationspartner:innen jetzt in Experimenten aufdeckten, schaltet Isofluran einen speziellen Importweg über die Blut-Hirn-Schranke an. Mithilfe hochauflösender Mikroskopie konnten die Wissenschaftler:innen nachweisen, dass Isofluran bestimmte Membranbereiche verändert, die besonders Cholesterin-reich sind. Ein Schlüsselprotein dieser Membrankompartimente ist das Caveolin. Es ist unter anderem beteiligt, Substanzen aus dem Blutstrom ins Gewebe zu transportieren.
„Schalter“ verändert Durchlässigkeit der Blut-Hirn-Schranke
„Wir wollten herausfinden, ob Isofluran direkt auf diesen Caveolin vermittelten Transport wirkt und über diesen Mechanismus die Durchlässigkeit der Blut-Hirn-Schranke erhöht“, erklärt Saher. Dazu narkotisierten die Wissenschaftler:innen gentechnisch veränderte Mäuse, in denen Caveolin ausgeschaltet war, mit Isofluran. Anders als in normalen Artgenossen, wurde in diesen Tieren die Blut-Hirn-Schranken nicht durchlässiger. „Dies bestätigt, dass Isofluran in diesen Transportprozess eingreift“.
„Wichtig für die sichere Anwendung war die Konzentration und Dauer der Anästhesie“, berichtet die Gruppenleiterin. Erhielten die Nager das Isofluran über längere Zeit in hoher Dosis, lagerte sich Flüssigkeit um die Blutgefäße ihres Gehirns an und bildete Ödeme. In Maßen angewandt, regenerierte die Blut-Hirn-Schranke sofort bei Abschalten der Betäubung. „Wenn wir den Mäusen das Isofluran in mittleren Dosen verabreichten, konnten wir die Durchlässigkeit der Blut-Hirn-Schranke wie mit einem Schalter steuern“, erklärt Lena Spieth, wissenschaftliche Mitarbeiterin von Gesine Saher und Erstautorin der Studie.
Besonders interessant für Sahers Team: In Mäusen, die an einem Hirntumor litten, wurde die Chemotherapie durch gleichzeitige Narkose mit Isofluran gefördert. Diese Ergebnisse sind einerseits mechanistisch sehr interessant, aber auch von großer translationaler Bedeutung. „Inhalations-Anästhetika könnten zukünftig neue Wege eröffnen, Erkrankungen des Nervensystems mit Medikamenten zu behandeln“, so die Gruppenleiterin.
(4.068 Zeichen inkl. Leerzeichen)
* Die in diesem Text verwendeten Genderbegriffe vertreten alle Geschlechtsformen.
Wilhelm Sander-Stiftung: Partnerin innovativer Krebsforschung
Die Wilhelm Sander-Stiftung hat das Forschungsprojekt mit knapp 119.000 Euro über 24Monate unterstützt. Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 270 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz ausbezahlt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen Unternehmers hervor, der 1973 verstorben ist.
Kontakt
Konstanze Adam
Wilhelm Sander-Stiftung
Presse- und Öffentlichkeitsarbeit & Stiftungskommunikation
Tel.: +49 (0) 89 544187-0
E-Mail: adam@sanst.de
Wissenschaftlicher Ansprechpartner:
Wissenschaftliche Ansprechperson
Dr. Gesine Saher
Leiter der Projektgruppe „Biologie der Lipide“
Abteilung für Neurogenetik
Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Hermann-Rein-Str. 3
37075 Göttingen
Tel.: +49 (0) 551 201 31 751
E-Mail: saher@mpinat.mpg.de
Originalpublikation:
Lena Spieth, Stefan A. Berghoff, Sina K. Stumpf, Jan Winchenbach, Thomas Michaelis, Takashi Watanabe, Nina Gerndt, Tim Düking, Sabine Hofer, Torben Ruhwedel, Ali H. Shaib, Katrin Willig, Katharina Kronenberg, Uwe Karst, Jens Frahm, Jeong Seop Rhee, Susana Minguet, Wiebke Möbius, Niels Kruse, Christian von der Brelie, Peter Michels, Christine Stadelmann, Petra Hülper, and Gesine Saher
Anesthesia triggers drug delivery to experimental glioma in mice by hijacking caveolar transport. Neuro-oncology advances 3, vdab140 (2021)
https://doi.org/10.1093/noajnl/vdab140
Weitere Informationen:
http://www.wilhelm-sander-stiftung.de
https://www.linkedin.com/company/wilhelm-sander-stiftung/
https://www.mpinat.mpg.de/de
Ähnliche Pressemitteilungen im idw