Neue Studie enthüllt „Nebenjob“ von Teilen der Proteinvernichtungsmaschine des Gehirns an den Synapsen
Eine neue Studie von Forscher:innen des Max-Planck-Instituts für Hirnforschung hat einen "Nebenjob" eines Komplexes aufgedeckt, der normalerweise für den Abbau von Proteinen in den Zellen zuständig ist: das Proteasom. Durch Zählen und Sichtbarmachen einzelner Proteinkomplexe fanden die Wissenschaftler:innen heraus, dass ein Teil des Proteasoms (der 19S-Regulationskomplex) in der Nähe von Gehirnsynapsen reichlich vorhanden ist, wo er synaptische Proteine und die Übertragung allein - ohne seinen Partner - reguliert.
Das menschliche Gehirn besitzt über 100 Billionen Synapsen. Diese synaptischen Verbindungen definieren neuronale Schaltkreise und speichern Informationen ein Leben lang. Die wichtigsten Funktionsmoleküle innerhalb der Synapsen, die Proteine, haben jedoch nur eine durchschnittliche Haltbarkeit von einer Woche. Das bedeutet, dass Synapsen ständig alte Proteine abbauen und neue Kopien synthetisieren müssen, um sie zu ersetzen. Die Homöostase der Proteine an den Synapsen ist für alle Aspekte der Gehirnfunktion von grundlegender Bedeutung und ihr Ungleichgewicht führt zu neurologischen Störungen. Die meisten zellulären Proteine des Gehirns werden von einer Multikomponenten-Maschine namens Proteasom abgebaut.
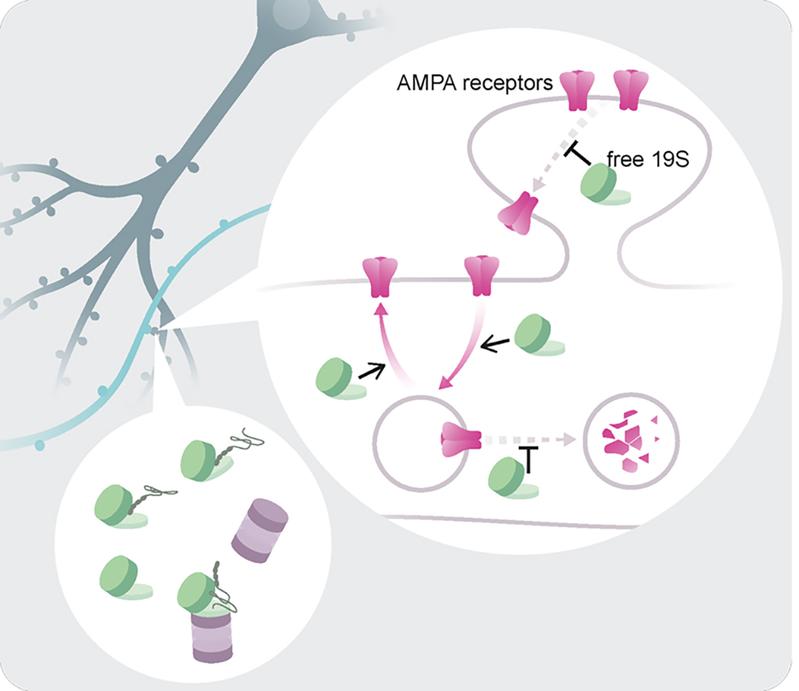
Das Proteasom, die Protein-Müllabfuhr der Zelle, besteht aus zwei Teilen: einem für die Erkennung der Proteine (dem sogenannten 19S-Komplex) und einem für deren Abbau (dem 20S-Komplex). Bisher ging man davon aus, dass der 19S-Komplex nur mit seinem Partner, dem 20S-Komplex, zusammenarbeitet. Eine kürzlich in Science veröffentlichte Studie aus dem Labor von Professor Erin Schuman (ebenfalls Direktorin am Max-Planck-Institut für Hirnforschung) zeigt, dass dies nicht immer der Fall ist. In den entlegenen Regionen des Neurons - den Dendriten, wo die Informationen an den Synapsen von einem Neuron zum anderen übertragen werden - zeigten "Super-Resolution"-Visualisierungsmethoden, dass der 19S-Komplex des Proteasoms viel häufiger vorkommt als der 20S-Komplex und oft allein zu finden ist. Überraschenderweise zeigten funktionelle Studien, dass das freie 19S-Partikel synaptische Proteine reguliert, ohne deren Abbau zu fördern. Es erkennt eine spezielle Gruppe synaptischer Moleküle (z. B. Neurotransmitter-Rezeptoren, auch AMPA-Rezeptoren genannt) und verändert deren Dynamik und Lokalisierung innerhalb der Synapse. Diese Studie offenbart einen faszinierenden und flexiblen Aspekt der Synapsenbiologie, bei dem sich komplexe Proteinmaschinen wahrscheinlich an subzelluläre Bedürfnisse angepasst haben und alternative Funktionen übernehmen.
Die Arbeit wurde von vielen Mitgliedern des Schuman-Labors, der Bildgebungseinrichtung und der Proteomikeinrichtung am MPIBR großzügig unterstützt. Der Hauptautor, Dr. Chao Sun, ist jetzt unabhängiger Gruppenleiter am Danish Research Institute of Translational Neuroscience - DANDRITE (Nordic-EMBL Partnership for Molecular Medicine) und der Universität Aarhus, Dänemark.
Wissenschaftlicher Ansprechpartner:
Chao Sun , Ph.D.
Institut for Molekylærbiologi og Genetik - Neurobiologi
Universitetsbyen 81
8000 Aarhus C
Dänemark
chaosun@dandrite.au.dk
Prof. Dr. Erin M. Schuman
Max Planck Institut für Hirnforschung
Max-von-Laue-Str. 4
60438 Frankfurt am Main
erin.schuman@brain.mpg.de
Originalpublikation:
DOI: 10.1126/science.adf2018
Ähnliche Pressemitteilungen im idw