Logistik im Gehirn: Neuer Link erklärt mRNA-Transport in Gehirnzellen
Max-Planck-Forschende aus Dresden, Dortmund, Frankfurt am Main und Göttingen haben gemeinsam den ersten Nachweis eines Proteinkomplexes erbracht, der für den Transport von Boten-RNA in Neuronen verantwortlich ist
Gehirnzellen können an jeder Ecke Proteine herstellen, auch in ihren langen Verzweigungen. Neuronen ohne diese Fähigkeit, verursachen schwere neurologische Störungen, die zu Behinderungen und Epilepsie führen können. Die Forschungsgruppen um Marino Zerial, Max-Planck-Institut (MPI) für molekulare Zellbiologie und Genetik in Dresden, und Stefan Raunser, MPI für molekulare Physiologie in Dortmund, haben zusammen mit Forschenden vom MPI für Hirnforschung in Frankfurt am Main und dem MPI für biophysikalische Chemie in Göttingen einen neuen Transportmechanismus entdeckt, der die Boten-RNA (mRNA), den Bauplan der Proteine, an den Ort des Bedarfs in den Neuronen bringt. Mithilfe einer Reihe von Techniken haben die Forschenden einen Proteinkomplex mit dem Namen FERRY identifiziert, der mRNA mit intrazellulären Trägern verbindet, und seine Rolle und Struktur aufgeklärt. Die Entdeckung könnte zu einem besseren Verständnis neurologischer Störungen führen, die durch eine Fehlfunktion von FERRY verursacht werden, und möglicherweise zu neuen medizinischen Anwendungen. Die Ergebnisse sind in zwei aktuellen Arbeiten beschrieben, die zusammen in der Fachzeitschrift Molecular Cell veröffentlicht wurden.
Weit weg und doch so nah!
„Diese Veröffentlichungen sind ein großer Fortschritt bei der Aufklärung der Mechanismen, die der mRNA-Verteilung in Gehirnzellen zugrunde liegen“, sagt Marino Zerial, Direktor am MPI in Dresden. Zellen produzieren lebenswichtige Proteine mithilfe von mRNA als Bauplan und Ribosomen als 3D-Drucker. Doch Gehirnzellen haben eine logistische Herausforderung zu bewältigen: Sie haben eine baumartige Form mit Verzweigungen, die sich im Gehirn über Zentimeter erstrecken können. „Das bedeutet, dass Tausende von mRNAs weit entfernt vom Zellkern transportiert werden müssen, was dem logistischen Aufwand bei der Versorgung aller Supermärkte eines ganzen Landes ähnelt“, sagt Jan Schuhmacher, Erstautor der Studie.
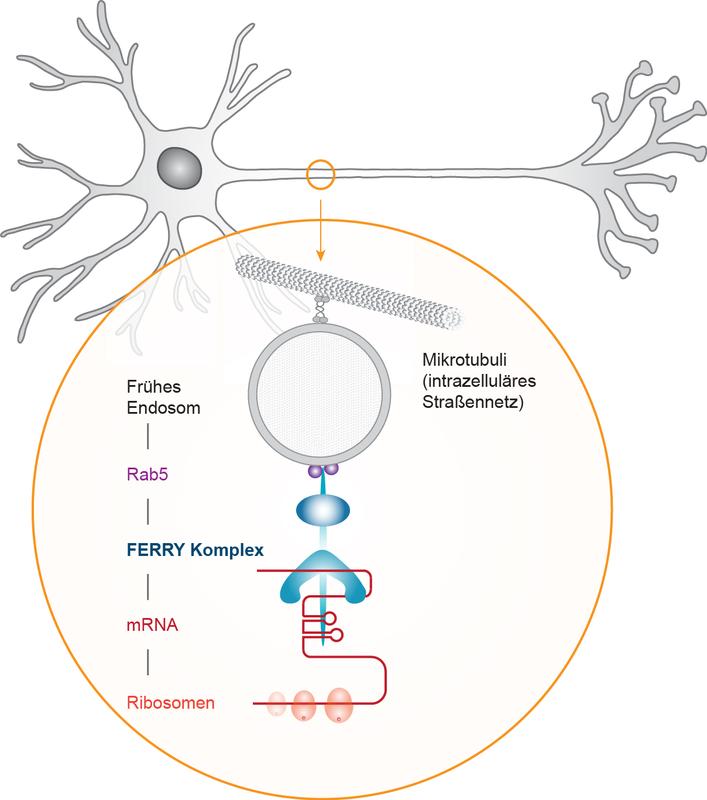
Bisher schrieben Forschende die Rolle des Transporteurs kugelförmigen Kompartimenten im Inneren der Zelle zu, den so genannten späten Endosomen. Die Max-Planck-Forschenden zeigen jedoch, dass sich auch eine andere Art der Kompartimente, die sog. frühen Endosomen (EEs) als mRNA-Träger eignen und zwar aufgrund ihrer Fähigkeit im intrazellulären Straßennetz in beide Richtungen zu fahren. In der ersten Veröffentlichung unter der Leitung von Marino Zerial, entdeckten die Forschenden die Funktion eines Proteinkomplexes, den sie FERRY (Five-subunit Endosomal Rab5 and RNA/ribosome intermediarY) nannten. In Neuronen ist FERRY mit EEs verbunden und funktioniert ähnlich wie ein Haltegurt beim Transport: Er interagiert direkt mit der mRNA und hält sie an den EEs fest, die damit zu logistischen Trägern für den Transport und die Verteilung der mRNA in den Gehirnzellen werden.
Komplexe Details
Aber wie bindet FERRY an die mRNA? An dieser Stelle kommt die Gruppe von Stefan Raunser vom MPI Dortmund ins Spiel. In der zweiten Veröffentlichung nutzten Dennis Quentin und seine KollegInnen die Kryo-Elektronenmikroskopie (Kryo-EM), um die Struktur von FERRY zu entschlüsseln und damit die molekularen Eigenschaften, die es dem Komplex ermöglichen, sowohl an EEs als auch an mRNAs zu binden. Das gewonnene 3D-Atommodell von FERRY mit einer Auflösung von 4 Ångström zeigt eine neuartige RNA-Bindung, die sogenannte Coiled-Coil Domänen involviert. Die Forschenden konnten auch klären, wie einige genetische Mutationen die Fähigkeit von FERRY, mRNA zu binden, beeinträchtigen, was zu neurologischen Störungen führt. „Unsere Forschung legt den Grundstein für ein umfassenderes Verständnis neurologischer Störungen, die durch einen fehlgeschlagenen mRNA-Transport oder fehlerhafte mRNA-Verteilung verursacht werden, was auch zur Identifizierung therapeutisch relevanter Ziele führen könnte“, sagt Raunser.
Wissenschaftlicher Ansprechpartner:
Korrespondierender Autor:
Prof. Dr. Stefan Raunser
Max-Planck-Institut für molekulare Physiologie
Tel.: +49 231 133 2300
E-Mail: Stefan.Raunser@mpi-dortmund.mpg.de
Korrespondierender Autor:
Prof. Dr. Marino Zerial
Max-Planck-Institut für molekulare Zellbiologie und Genetik
Tel.: +49 351 210 1100
E-Mail: zerial@mpi-cbg.de
Originalpublikation:
Jan S. Schuhmacher, Susanne tom Dieck, Savvas Christoforidis, Cedric Landerer, Jimena Davila Gallesio, Lena Hersemann, Sarah Seifert, Ramona Schäfer, Angelika Giner, Agnes Toth-Petroczy, Yannis Kalaidzidis, Katherine E. Bohnsack, Markus T. Bohnsack, Erin M. Schuman, Marino Zerial: The Rab5 effector FERRY links early endosomes with mRNA localization, Molecular Cell, June 1, 2023
Dennis Quentin, Jan S. Schuhmacher, Björn U. Klink, Jeni Lauer, Tanvir R. Shaikh, Pim J. Huis in ’t Veld, Luisa M. Welp, Henning Urlaub, Marino Zerial, Stefan Raunser: Structural basis of mRNA binding by the human FERRY Rab5 effector complex, Molecular Cell, June 1, 2023
Ähnliche Pressemitteilungen im idw