Fataler Kreislauf für Tumorzellen
Selbstopfernde Polyferrocene für die Tumor-Therapie
Antitumor-Wirkstoffe sollen Krebszellen effektiv abtöten, gesundes Gewebe aber schonen und möglichst keine toxischen Nebenwirkungen haben. Ein neuartiger Ansatz könnte diese Forderungen erfüllen. Er basiert auf „selbstopfernden“ Polyferrocenen, speziellen Copolymeren, die sich von selbst in ihre Bestandteile aufspalten, sobald sie in Tumorzellen gelangen. Die eingebauten Wirkstoffe sorgen dann synergistisch für eine schlagartige Zunahme freier Radikale bei lahmgelegter Gegenwehr der Tumorzellen, wie ein Forschungsteam in der Zeitschrift Angewandte Chemie berichtet.
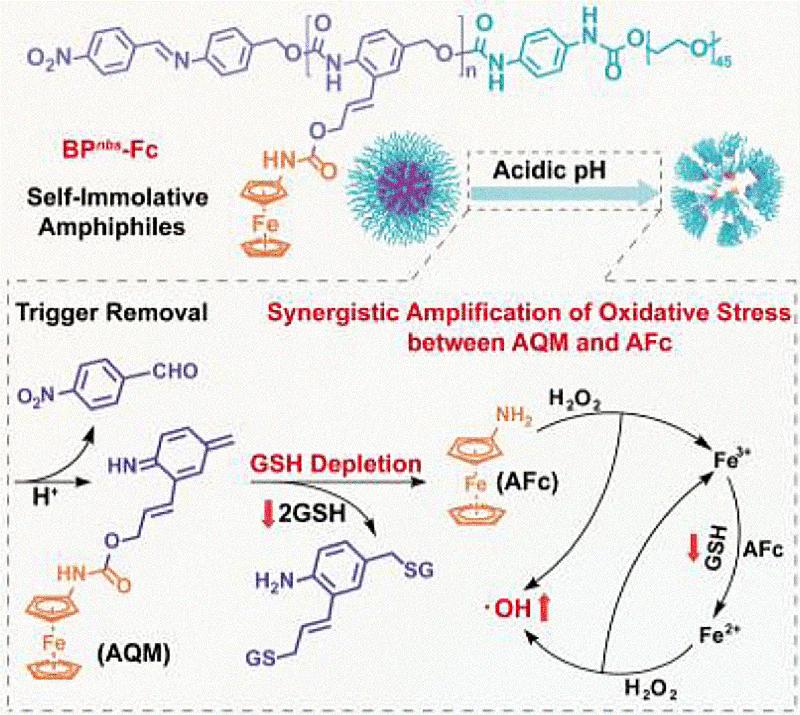
Das Team von der University of Science and Technology of China (Hefei) um Xianglong Hu und Shiyong Liu baute die zwei synergistisch zusammenwirkenden Moleküle gemeinsam in ein Copolymer ein. Die Copolymer-Ketten besitzen ein wasserabweisendes und ein wasserfreundliches Ende. In wässrigem Milieu ballen sie sich zu Nanopartikeln zusammen, indem sich die wasserabweisenden Enden zusammen im Inneren zusammenlagern und von den äußeren, wasserfreundlichen Bereichen aus Polyethylenglykol abgeschirmt werden. Polyethylenglykol ist ein ungiftiges Polymer, das in Kosmetik und Medizin breit eingesetzt wird. Die Polyethylenglykolschicht verhindert, dass die Nanopartikel im Blut rasch von Bestandteilen des Immunsystems abgebaut werden.
In gesundem Gewebe bleiben die Nanopartikel intakt und damit inaktiv. Erst das viel saurere Milieu von Tumorzellen löst den Prozess der „Selbstopferung“ aus: Die Partikel fallen auseinander und die wasserabweisenden Enden der Polymerketten spalten sich selbsttätig in ihre einzelnen Bausteine. Diese bestehen aus Azachinonmethid-Einheiten, an die über ein Verbindungsstück Aminoferrocene, spezielle Eisen-Komplexe gebunden sind. Es handelt sich dabei um sogenannte Sandwich-Komplexe: Ein Eisenion ist als „Belag“ zwischen zwei flachen aromatischen Kohlenstoff-Fünfringen als „Brotscheiben“ gebunden.
In den Tumorzellen wird daraufhin Glutathion aktiv, ein Radikalfänger und Antioxidans, das hilft, Fremdstoffe aus Zellen auszuschleusen. Glutathion greift die Azachinonmethid-Einheiten an, bindet daran und spaltet den Eisen-Sandwich ab. Einmal freigesetzt reagiert dieser mit in den Zellen vorhandenem Wasserstoffperoxid (H2O2) unter Bildung von Hydroxylradikalen (•OH). Das zweiwertige Eisen des Komplexes wird dabei zu dreiwertigem Eisen oxidiert und anschließend von Glutathion wieder zu zweiwertigem Eisen reduziert, das dann erneut durch H2O2 oxidiert wird – ein für die Zelle fataler Kreislauf, der das Glutathion aufbraucht und schlagartig eine hohe Konzentration an Hydroxylradikalen erzeugt. Die Synergie beider Prozesse setzt die Tumorzellen unter starken oxidativen Stress, der sie schädigt und abtötet. Das Tumorwachstum ließ sich so bei vernachlässigbaren Nebenwirkungen effizient hemmen, wie das Team in vitro und in Tumormäusen zeigen konnte. Der Ansatz könnte neue Möglichkeiten für eine chemodynamische Therapie (CDT) von Tumoren eröffnen.
Angewandte Chemie: Presseinfo 26/2023
Autor/-in: Shiyong Liu, University of Science and Technology of China, http://en.scms.ustc.edu.cn/2011/0702/c13455a89225/page.htm
Angewandte Chemie, Postfach 101161, 69451 Weinheim, Germany.
Die "Angewandte Chemie" ist eine Publikation der GDCh.
Originalpublikation:
https://doi.org/10.1002/ange.202303829
Weitere Informationen:
http://presse.angewandte.de
Ähnliche Pressemitteilungen im idw