Ein einziges Molekül bringt Symbiose aus dem Gleichgewicht
Eine funktionierende Symbiose zum beiderseitigen Vorteil kann sehr fragil sein, das zeigt eine neue Studie zum Zusammenleben von Bakterien und Pilzen. Forschende des Leibniz-Instituts für Naturstoff-Forschung und Infektionsbiologie (Leibniz-HKI) in Jena fanden heraus, dass die Bakterienart Mycetohabitans rhizoxinica nur dann unbehelligt in den Hyphen des Pilzes Rhizopus microsporus lebt, wenn sie ein bestimmtes Protein produziert.
In einer Symbiose schließen sich zwei Organismen zusammen und profitieren voneinander, bei der Endosymbiose lebt einer der Organismen gar im anderen. Und manchmal können sie gar nicht mehr ohne einander, wie der Pilz Rhizopus microsporus und das Bakterium Mycetohabitans rhizoxinica (vorher bekannt als (Para)burkholderia rhizoxinica). Der Pilz kann Reiskeimlingsfäule auslösen, die jedes Jahr zu enormen Ernteverlusten in Asien führt. Dafür braucht er jedoch M. rhizoxinica: Das Bakterium produziert ein Pflanzengift, das von dem Pilz weiterverarbeitet und ausgeschüttet wird. Ohne das Bakterium kann der Pilz außerdem keine Sporen mehr bilden – sich also nicht mehr effizient verbreiten. Im Gegenzug versorgt er seinen Endosymbionten mit Nährstoffen.
„In der freien Wildbahn leben die beiden immer in Symbiose“, erklärt Ingrid Richter, Postdoktorandin in der Abteilung Biomolekulare Chemie am Leibniz-HKI. Im Labor ist es den Forschenden jedoch gelungen, sie getrennt voneinander zu kultivieren. „Dadurch wissen wir, dass die Bakterien weiterhin in der Lage sind, den Pilz zu infizieren“, so Richter.
Von Parasitismus zu Symbiose?
Das Forschungsteam fand nun heraus, dass ein bestimmtes Bakterienprotein, genauer ein Effektorprotein, die Symbiose aufrechterhält. Deaktivieren die Forschenden den sogenannten TAL-Effektor 1 (MTAL1), vermehren sich die Bakterien unkontrolliert und der Pilz trennt Teile seiner Hyphen ab. Die so eingefangenen Bakterien sterben in der Folge ab. „Diese TAL-Effektoren sind von verschiedenen Pflanzen infizierenden Bakterien bekannt“, so Richter. Sie ermöglichen den Bakterien, in Pflanzenzellen einzudringen.
Im Fall von R. microsporus und M. rhizoxinica hat sich möglicherweise ein ursprünglich parasitäres Verhältnis in ein symbiotisches Verhältnis gewandelt. Ist das Effektorprotein nicht vorhanden, können die Bakterien den Pilz nämlich weiterhin infizieren – das heißt sie „schmelzen“ die Zellwand und dringen in die Pilzhyphen ein. Sie werden dann jedoch vom Pilz als parasitär wahrgenommen. Nur wenn der TAL-Effektor vorhanden ist, ist die Symbiose stabil. „Das zeigt den fließenden Übergang zwischen einer Symbiose zum Vorteil beider Partner und einem möglicherweise parasitischen Verhältnis, das für einen Partner nachteilig sein kann“, so Richter.
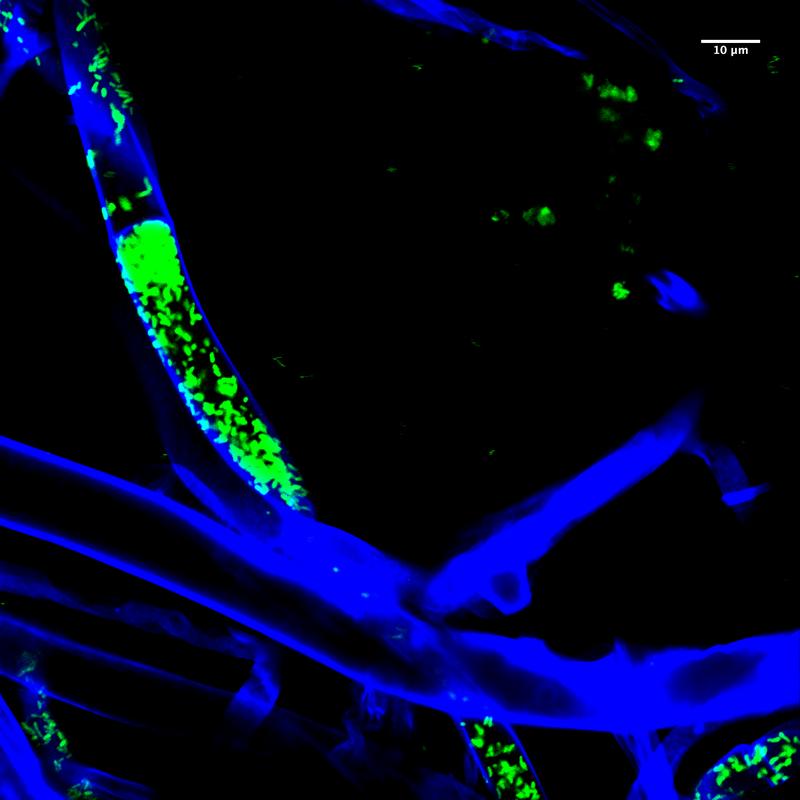
Genaue mikroskopische Beobachtung
Um den Infektionsprozess genau beobachten zu können, haben die Forschenden ein ausgeklügeltes System entwickelt: Sie nutzen Mikrofluidik-Chips mit sehr schmalen Kanälen, in die sie den Pilz hineinwachsen lassen. In einem Kanal ist dabei nur Platz für eine einzige Pilzhyphe. Anschließend geben sie die Bakterien hinzu und beobachten den Infektionsprozess über mehrere Stunden unter dem Mikroskop. „Durch das Design wachsen die fadenförmigen Hyphen nicht übereinander, so können wir genau sehen, was passiert“, erklärt Richter. Sie konnte zeigen, dass der Pilz zusätzliche Querwände in den Hyphen aufbaut, wenn der TAL-Effektor ausgeschaltet ist – und dass in den so abgetrennten Bereichen besonders viele Bakterien vorhanden sind. „Durch bestimmte Farbstoffe können wir sehen, dass die eingeschlossenen Bakterien nach einigen Stunden absterben.“
Die Forschenden wollen nun weiter untersuchen, welche zellulären Prozesse durch das Effektorprotein angestoßen werden. „Wir vermuten, dass der TAL-Effektor im Pilzgenom bindet, weil das typisch ist für diese Proteine – wir wissen aber nicht, wo“, so Richter. Ein Grund dafür: Das Genom von R. microsporus ist bisher nicht vollständig entschlüsselt.
Die Forschungsergebnisse geben neue Einblicke in endosymbiotische Partnerschaften, die in der Evolution eine große Rolle spielen. So waren wahrscheinlich die heutigen Mitochondrien, die Energieversorger in pflanzlichen, tierischen und Pilz-Zellen, ursprünglich Endosymbionten. Sie haben ihre eigene DNA, sind allerdings schon lange nicht mehr in der Lage, unabhängig zu überleben – anders als M. rhizoxinica. „Zusätzlich haben wir über die genaue mikroskopische Beobachtung einiges darüber gelernt, welche Aufgaben verschiedene Arten von Hyphen im Pilzmyzel haben, zum Beispiel den Transport von Nährstoffen“, erklärt Richter.
Die Forschungsarbeit wurde durch die EU im Rahmen eines Marie Skłodowska-Curie-Stipendiums für Ingrid Richter, durch die Deutsche Forschungsgemeinschaft im Rahmen des Exzellenzclusters Balance of the Microverse, des Sonderforschungsbereichs ChemBioSys, der Jena School for Microbial Communication und des Leibniz-Preises für den Studienleiter Christian Hertweck sowie durch den Schweizerischen Nationalfonds unterstützt.
Wissenschaftlicher Ansprechpartner:
Ingrid Richter
Abteilung Biomolekulare Chemie, Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie
ingrid.richter@leibniz-hki.de
Originalpublikation:
Richter I, Wein P, Uzum Z, Stanley CE, Krabbe J, Molloy EM, Moebius N, Stinear TP, Pidot SJ, Ferling J, Hillmann F, Hertweck C (2023) Transcription activator-like effector protects bacterial endosymbionts from entrapment within fungal hyphae. Current Biology, https://doi.org/10.1016/j.cub.2023.05.028
Weitere Informationen:
http://Weiteres Bild- und Videomaterial zum Download finden Sie hier: https://nextcloud.hki-jena.de/index.php/s/jQxDAzq3CiTtkc5
Ähnliche Pressemitteilungen im idw