Proof-of-Concept-Förderung des ERC für 'Design2Guide': Neue Designstrategie für experimentelle Modelle von Tumorgeweben
Forscher:innen des Leibniz-Instituts für Polymerforschung Dresden nutzen eine Hydrogel-basierte Plattform, um eine rationale Designstrategie für Modelle von Tumorgeweben zu entwickeln und bessere Therapieoptionen für Menschen mit Bauchspeicheldrüsenkrebs zu finden. Um die Forschung voranzutreiben, erhielt das interdisziplinäre Team von Professorin Daniela Lössner vom Europäischen Forschungsrat (ERC) jetzt eine Proof-of-Concept-Förderung für das Projekt 'Design2Guide: Cell-instructive matrices to deconstruct tumour tissues'.
Die Forschung des Teams geht ein klinisches Problem mit einem innovativen Ansatz an. Bauchspeicheldrüsenkrebs ist eine der tödlichsten Krebsarten und nur 10 % der Menschen, bei denen diese Krankheit diagnostiziert wird, überleben fünf Jahre nach der Diagnose. Um bessere Therapien zu finden, werden patientenspezifische Modelle entwickelt, die die Biologie des Tumorgewebes und Wechselwirkungen zwischen verschiedenen Zelltypen nachahmen. Ziel von 'Design2Guide' ist es, eine steuerbare Plattform für experimentelle Studien an der menschlichen Krankheit im Labor zu schaffen. Die neue Plattform soll dazu dienen, bessere Behandlungsmöglichkeiten für die Krankheit zu finden.
Die schlechte Prognose bei Bauchspeicheldrüsenkrebs hängt u.a. damit zusammen, dass die Tumore von fibrotischem Gewebe und einer extrazellulären Kollagenmatrix umgeben sind. Matrixproteine regulieren wichtige Zellfunktionen. Mit verfügbaren experimentellen Modellen können das fibrotische Gewebe und die Matrix dieser Krankheit nicht nachgebildet werden. Mehrere Studien, darunter zwei des Teams von Daniela Lössner (Advanced Healthcare Materials 2022 doi: 10.1002/adhm.202201907, Nature Communications 2021 doi: 10.1038/s41467-021-25921-9), haben die Schlüsselrolle von einzelnen Matrix-Komponenten bei der Steuerung von Zellfunktionen aufgezeigt und betonen die Notwendigkeit, Hydrogel-basierte Systeme zu entwickeln.
Das Problem:
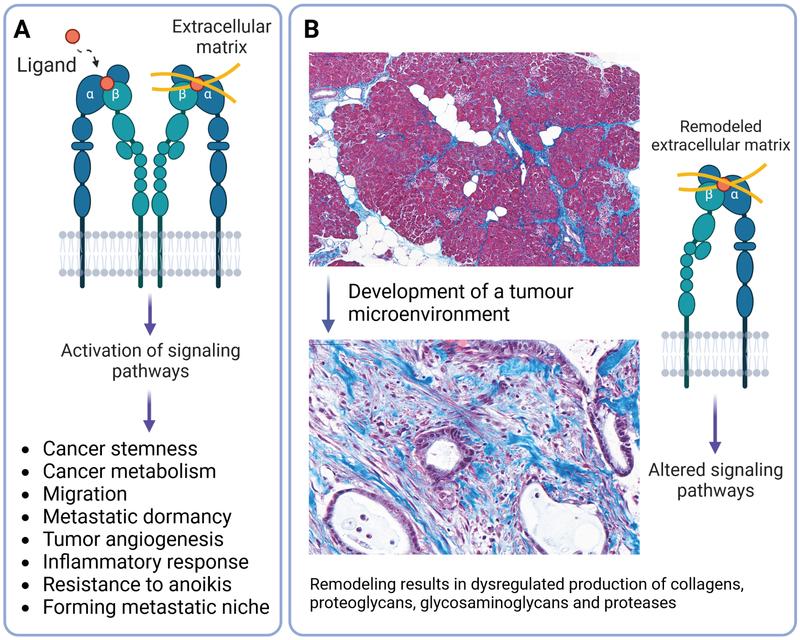
Die extrazelluläre Matrix von Bauchspeicheldrüsenkrebs ist sehr komplex und besteht aus vielen fibrotischen Proteinen, darunter Kollagene, Proteoglykane, Laminine und Fibronektin. In Tumorgeweben stimuliert der Umbau der Matrix das Wachstum von Krebszellen, die ihrerseits über Integrine, eine wichtige Klasse von Zelloberflächen- und Adhäsionsrezeptoren, mit der Matrix interagieren (Abbildung 1A). Integrine erleichtern die Zell-Zell- und Zell-Matrix-Interaktionen in der Umgebung des Tumors und steuern Signalwege, die zum Fortschreiten der Krankheit und zur Metastasierung führen (Abbildung 1B). Daher sind Integrine zu einem wichtigen Gegenstand der Forschung an neuen Therapien geworden, die in klinischen Studien getestet werden. Allerdings fehlt trotz der bedeutenden Rolle der Zelladhäsion ein robuster technischer Ansatz, um das spezifische Adhäsionsprofil von Krebszellen nachzuahmen und das krankheitsrelevante Integrinprofil in experimentellen Modellen zu untersuchen.
Die Lösung:
'Design2Guide' schlägt eine rationale Designstrategie für ein krankheitsrelevantes 3D-Krebsmodell vor, die auf zwei grundlegenden Aspekten beruht: Erstens einer minimalistischen synthetischen Matrix, die individuelle Matrixkomponenten von Tumorgeweben in Form von Polyethylenglycol-Hydrogelen enthält, und zweitens der Fähigkeit, Integrinprofile zu steuern und anschließend Signalwege zu aktivieren. Die 'Design2Guide'-Plattform zielt auf die Entwicklung Hydrogel-basierter Systeme zur Nachahmung von Tumorgewebe ab, um die Zell-Zell- und Zell-Matrix-Interaktionen bei Menschen mit Bauchspeicheldrüsenkrebs zu untersuchen. Die Forschung wird Wissenschaftler:innen auf dem Gebiet des Engineering von Tumorgewebe zugutekommen. Dieses neue, interdisziplinäre Forschungsgebiet verbindet Tissue Engineering und Zellbiologie (Nature Reviews Materials 2023 doi:10.1038/s41578-023-00535-3).
Die Bedeutung der neuen Plattform besteht vor allem darin, dass sie künftig erlauben wird, Zelladhäsion in Geweben in synthetischen Matrizen besser nachzubilden und somit neue Erkenntnisse für die Forschung an Krebstherapien ermöglicht.
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Daniela Lössner
loessner@ipfdd.de
Originalpublikation:
Advanced Healthcare Materials, doi: 10.1002/adhm.202201907
Nature Communications, doi: 10.1038/s41467-021-25921-9
Nature Reviews Materials, doi:10.1038/s41578-023-00535-3
Ähnliche Pressemitteilungen im idw