Entwicklung eines Impfstoffes zum Schutz vor der Cytomegalovirus-Erkrankung nach Blutstammzelltransplantation
Forschenden um Bodo Plachter von der Universitätsmedizin Mainz gelang es in einer vorklinischen Studie einen Impfstoff gegen den Cytomegalovirus (CMV) zu entwickeln. Dies könnte besonders bei malignen Erkrankungen, wie der Leukämie, bei denen eine Transplantation von Blutstammzellen (HSCT) erforderlich ist, relevant werden. Eine CMV-Infektion stellt hier eine schwere, in manchen Fällen lebensbedrohliche, Komplikation dar. Sofern sich der auf nicht-infektiösen Partikeln basierende Impfstoff auch in klinischen Studien bewährt, könnte damit das Komplikationsrisiko bei Transplantationen reduziert werden. Die Wilhelm Sander-Stiftung hat das Projekt mit knapp 320.000 € über 4 Jahre unterstützt.
Die hämatopoetische Stammzellentransplantation (HSCT) ist bei schweren Erkrankungen des blutbildenden Systems (z.B. Leukämie, myelodysplastisches Syndrom, angeborene Anämien) und bei Lymphomen eine bewährte Therapie. Aufgrund der für die HSCT nötigen Unterdrückung des Immunsystems sind die Erkrankten gegenüber Infektionen besonders anfällig. Eine besonders schwerwiegende Komplikation ist das Wiederaufleben (Reaktivierung) der Infektion mit dem Cytomegalovirus (CMV), einem Herpesvirus. Cytomegaloviren verbleiben nach einer Erstinfektion im Körper, werden aber vom Immunsystem dauerhaft in Schach gehalten. Bei unterdrücktem Immunsystem können sie aber reaktivieren und schwere Krankheitsbilder bei HSCT-Patienten verursachen, die lebensbedrohlich werden können. Im Augenblick verfolgen viele Zentren die Strategie, die CMV Reaktivierung durch eine Prophylaxe mit der antiviralen Substanz Letermovir zu unterdrücken. Allerdings wird diese Prophylaxe nur in den ersten 100 Tagen nach Transplantation angewendet, sodass sich die Problematik der CMV-Reaktivierung nur zeitlich verschiebt.
Um der CMV-Reaktivierung zuvorzukommen, soll das vom Spender übertragene Immunsystem durch eine Impfung stimuliert werden. Hierzu hat die Gruppe einen Impfstoff gegen CMV auf der Grundlage nicht-infektiöser, viraler Partikel, sogenannter Dense Bodies (DBs) entwickelt. Diese DBs hatten sich bereits im Vorfeld als außerordentlich wirksam herausgestellt, denn selbst ohne den Zusatz von Wirkverstärkern konnten mit diesem Impfstoff im Tierversuch Antikörper und Immunzellen gegen das Virus gebildet werden. Um diese für einen Totimpfstoff außergewöhnlich hohe Wirksamkeit näher zu beleuchten, haben die Forschenden umfangreiche Untersuchungen zum Einfluss der DB-Vakzine auf Zellen durchgeführt. Sie zeigten, dass DBs aktiv von solchen Zellen aufgenommen werden, die die Stimulation der Immunantwort vermitteln. Diese Zellen werden in der Folge durch die DB-Behandlung zur Ausreifung gebracht. Ein Prozess, der entscheidend für die Bildung von antiviralen Antikörpern und T-Lymphozyten ist, jedoch nicht alleine die herausragende Wirksamkeit von DBs erklären kann.
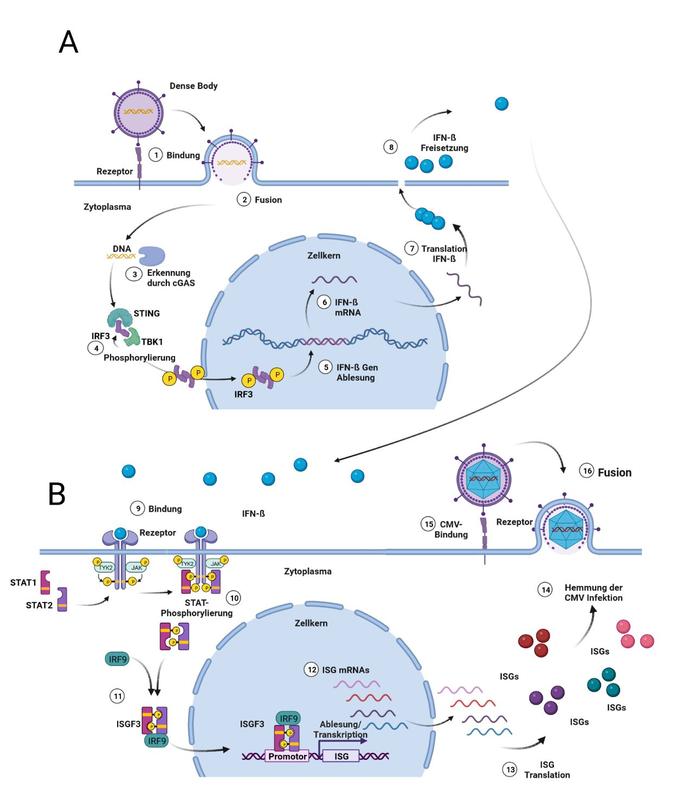
Um dies weiter aufzuklären, wurde in einer umfassenden Analyse untersucht, wie die Zelle auf DBs reagiert. Es konnte dabei eine überraschend deutliche Stimulation der angeborenen Abwehrmechanismen des Körpers gegen Infektionen dokumentiert werden. So wurde gezeigt, dass DBs über die Stimulation der Freisetzung des Mediators Interferon-β (IFN-β) die Bildung einer Vielzahl von Eiweißmolekülen (Proteinen) in der Zelle (Interferon-stimulierte Proteine) induziert, denen antivirale Wirksamkeit zugeschrieben wird. Gleichzeitig kam es zur Induktion von weiteren Proteinen, die für die Bildung von Antikörpern und Immunzellen wichtig sind (1, 2). Somit konnten die Mechanismen geklärt werden, wie es zu der sehr starken Immunantwort durch die DB-Vakzine kommt.
Gleichzeitig belegen diese Befunde aber auch, dass DBs bereits vorbestehende Abwehrmechanismen in den Zellen stimulieren. Aufbauend darauf konnte das Team zeigen, dass die Vorbehandlung von Zellen mit DBs die nachfolgende Infektion mit CMV behindert (3). Da DBs von infizierten Zellen freigesetzt werden, ergibt sich die Hypothese, dass diese Partikel ähnlich wie Interferone benachbarte Zellen gegenüber der CMV-Infektion schützen. In Zusammenarbeit mit der Gruppe von Profs. Lemmermann und Reddehase aus dem Institut in Mainz konnte im Tiermodel der HSCT schließlich die Wirksamkeit des DB-Impfstoffes beim Schutz gegenüber der CMV Infektion nachgewiesen werden (4).
„Die Ergebnisse der Experimente und das im Rahmen des Projektes etablierten Saat-Virus (5,6) sind von außerordentlicher Bedeutung für die Durchführung einer ersten, klinischen Studie. Dafür sollen im nächsten Schritt die notwendigen Prozesse etabliert werden, so beispielsweise das Verfahren zur Impfstoffproduktion“, so Professor Plachter. „Wir sind zuversichtlich, dass auch die klinische Studie erfolgreich sein wird und später dann auch tatsächlich ein für die Patientenversorgung einsetzbarer Impfstoff zur Verfügung stehen wird“.
(4.927 Zeichen inkl. Leerzeichen)
* Die in diesem Text verwendeten Genderbegriffe vertreten alle Geschlechtsformen.
Wilhelm Sander-Stiftung: Partnerin innovativer Krebsforschung
Die Wilhelm Sander-Stiftung hat das Forschungsprojekt mit knapp 320.000 Euro über 4 Jahre unterstützt. Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 270 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz ausbezahlt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen Unternehmers hervor, der 1973 verstorben ist.
Kontakt
Konstanze Adam
Wilhelm Sander-Stiftung
Presse- und Öffentlichkeitsarbeit & Stiftungskommunikation
Tel.: +49 (0) 89 544187-0
E-Mail: adam@sanst.de
Wissenschaftlicher Ansprechpartner:
Univ.-Prof. Dr. med. Bodo Plachter
Institut für Virologie
der Universitätsmedizin Mainz
Obere Zahlbacher Str. 67
55131 Mainz
Tel.: +49 (0) 63131 17 92 32
E-Mail: plachter@uni-mainz.de
Originalpublikation:
1. Penner I, Büscher N, Dejung M, Freiwald A, Butter F, Plachter B. 2022. Subviral Dense Bodies of Human Cytomegalovirus Induce an Antiviral Type I Interferon Response. Cells 11 doi: 10.3390/cells11244028
2. Penner I, Dejung, M Freiwald, A Butter, F Jia-Xuan, C Plachter,B. 2023. Proteome changes of fibroblasts and endothelial cells upon incubation with human cytomegalovirus Dense Bodies. Scientific Data doi:10.1038/s41597-023-02418-2. doi: 10.1038/s41597-023-02418-2
3. doi: 10.3390/v15061333
4. doi: 10.3389/fimmu.2021.694588
5. doi: 10.3390/vaccines7030104
6. doi: 10.3390/vaccines10081326
Weitere Informationen:
http://www.wilhelm-sander-stiftung.de
https://www.linkedin.com/company/wilhelm-sander-stiftung/
Ähnliche Pressemitteilungen im idw