Leberfibrose: Riesenzellen springen ein, wenn die Immunfunktion ausfällt
Forschende der Charité und der Universität Calgary entdecken neue Art von Zellen
Es ist ein Kompensationsmechanismus der kranken Leber und er war bislang unbekannt: Verlieren Immunzellen in der Leber, die Kupffer-Zellen, durch eine Vernarbung des Gewebes ihre Funktion, strömen Immunzellen aus dem Knochenmark in das Organ und bilden größere Zellcluster, um ihre Aufgaben zu übernehmen. Wissenschaftler:innen der Charité – Universitätsmedizin Berlin und der Medizinischen Fakultät der Universität Calgary konnten erstmals beobachten, wie die geschädigte Leber ihre bakterielle Filterfunktion aufrechterhält. Ihre grundlegenden Erkenntnisse sind kürzlich im Fachmagazin Science* erschienen.
Gemeinsame Pressemitteilung der Charité – Universitätsmedizin Berlin und der Cumming School of Medicine der Universität Calgary
Die Leber ist ein erstaunliches Organ. Sie ist das zentrale Stoffwechselorgan des Körpers und sowohl für die Aufnahme von Nährstoffen als auch für den Abbau von Giften verantwortlich. Sie reguliert den Fett- und den Zuckerstoffwechsel, den Mineral-, Vitamin- und Hormonhaushalt. Sie ist in der Lage, sich selbst zu regenerieren. Und: Weniger bekannt, aber überlebenswichtig ist ihre Rolle als zentrales immunologisches Organ. Die Leber hat wesentlichen Anteil daran, unseren Blutstrom frei von Krankheitserregern, von Bakterien, Viren oder Pilzen, zu halten. Kommt es zu einer Sepsis, landläufig auch Blutvergiftung genannt, werden über 90 Prozent der Eindringlinge von der Leber herausgefiltert.
Diese essenzielle Leistung des Organs wird durch eine spezialisierte Abwehrzelle erbracht – eine Fresszelle mit dem Namen Kupffer-Zelle, benannt nach dem deutsch-baltischen Anatomen Karl Wilhelm von Kupffer. Um ihre Filterfunktion zu erfüllen, sitzen Kupffer-Zellen in den kleinen Blutgefäßen der Leber, den Sinusoiden, und erhalten konstant Signale von Leberzellen und Zellen, die die Blutgefäße der Leber auskleiden. Bei schwerwiegenden Erkrankungen, allen voran chronischen Lebererkrankungen, führen Schädigungen der Leber zu einer Ansammlung von Narbengewebe, einer Fibrose, die die Funktionen des Organs einschränkt. Im fortgeschrittenen Stadium dieses Gewebeumbaus erfährt auch das Umfeld der Kupffer-Zellen fatale Veränderungen – die Folgen waren bislang ungeklärt.
Diesem Phänomen ist ein Forschungsteam um den Immunologen Prof. Dr. Paul Kubes an der Cumming School of Medicine der Universität Calgary zusammen mit Kolleg:innen an der Charité auf den Grund gegangen, nicht zuletzt, um Patient:innen mit einer fibrotischen Leber künftig besser behandeln zu können. Chronische Lebererkrankungen nehmen weltweit stark zu. In Deutschland führen vor allem starker Alkoholkonsum und die Fettlebererkrankung zu Leberfibrose und ihrem Endstadium, der Leberzirrhose. Die Fettleber betrifft Schätzungen zufolge schon jetzt jeden vierten Menschen und hat ihre Ursache in Lebensgewohnheiten wie Überernährung und Bewegungsmangel sowie Erkrankungen wie Diabetes und Fettstoffwechselstörungen. Auch Infektionen oder genetische Ursachen können zu Leberfibrose führen. Obwohl es bereits gute Modelle für Lebererkrankungen gibt, konnte bisher noch niemand das Voranschreiten der Leberfibrose und die zentrale Filterfunktion währenddessen darstellen.
Rolle des Immunsystems bei Leberfibrose in neuem Licht
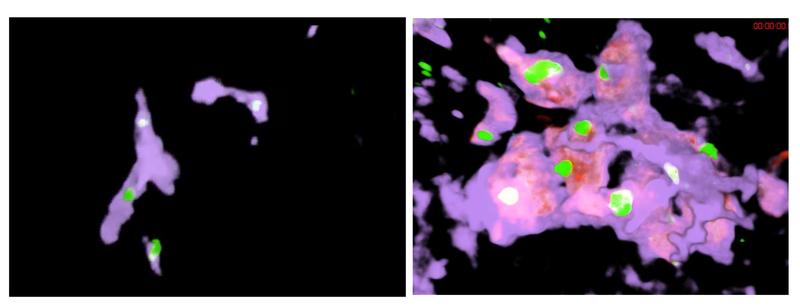
Genau das ist dem internationalen Team jetzt gelungen. Unter Einsatz einer neuartigen Mikroskopie-Technik, die es erlaubt, im lebenden Organismus zelluläre Funktionen im Detail zu beobachten, sowie weiteren Mikroskopie-Techniken haben die Forschenden die Funktion von Kupffer-Zellen im Tiermodell und in Gewebeproben von Patient:innen mit Leberzirrhose eingehend untersucht. Dabei konnten sie einen neuen Zelltyp ausmachen, den sie als Kupffer-Zell-ähnliche Synzytien bezeichnen. Es handelt sich um eine Art Riesenzellen – größere, mehrkernige Zellverbände, hervorgegangen aus herbeigeeilten Immunzellen des Knochenmarks.
Dr. Moritz Peiseler, Wissenschaftler und Arzt an der Klinik für Hepatologie und Gastroenterologie der Charité sowie Erstautor der Studie, beschreibt, was im Zuge des narbigen Umbaus in der Leber geschieht: „Mehr und mehr Leberzellen sterben ab. Im gesamten Organ und um die kleinen Blutgefäße bildet sich Bindegewebe. Das Blut wird auf neue, erweiterte Gefäße innerhalb und außerhalb der Leber umgeleitet. Dadurch verlieren die Kupffer-Zellen den Kontakt mit ihrer Umgebung und verhalten sich schließlich nicht mehr so, als befänden sie sich in der Leber. Sie verlieren ihre Funktion, fangen keine Bakterien mehr aus dem Blut auf und Infektionen des Blutkreislaufs nehmen zu. Doch recht schnell infiltrieren spezialisierte Monozyten, Immunzellen aus dem Knochenmark, die Leber. Sie folgen den Umgehungsgefäßen und bilden Cluster, die groß genug sind, um Bakterien in den etwas größeren Gefäßen abzufangen.“ Eine lebensrettende Kompensation, ausgelöst durch das Mikrobiom, vermutlich das Mikrobiom des Darms.
Die Kupffer-Zell-ähnlichen Gebilde übernehmen fortan die Filterfunktion der eigentlichen Kupffer-Zellen. Da sie in veränderten Blutgefäßen existieren müssen, passen sich die eingewanderten Immunzellen an. Sie bilden netzartige Strukturen und werden so zu einem effektiven mikrobiellen Filter. Welche molekularen Mechanismen an diesen Vorgängen beteiligt sind, konnten die Forschenden in ihrer Arbeit beschreiben. „Diese Erkenntnisse verändern die Art und Weise, wie wir über die Rolle des Immunsystems bei einer Leberfibrose denken“, befindet Studienleiter Prof. Kubes. „So war man bisher mitunter der Auffassung, dass Immunzellen aus dem Knochenmark daran gehindert werden sollten, in die Leber einzudringen. Wie unsere Untersuchung zeigt, könnte aber genau das schädlich sein. Statt die Immunfunktion bei einer fortgeschrittenen Erkrankung zu unterdrücken, könnte es sogar eine gute Idee sein, sie zu fördern.“
Grundlage für neuartige Therapien und Behandlung der Leberfibrose
Die Studie wurde an drei großen Lebertransplantationszentren, unter ihnen die Charité, durchgeführt und hat gezeigt, dass die Vorgänge bei einer Leberfibrose beim Menschen ähnlich verlaufen, wie im Tiermodell beobachtet. Daher werfen die Entdeckungen grundsätzliche Fragen für die Behandlung von Patient:innen mit fibrotischer Leber auf. Einer der Hauptgründe, weshalb Patient:innen mit Leberzirrhose versterben, ist eine Infektion. Gleichzeitig leiden viele Erkrankte an teils fortgeschrittener Lebervernarbung, ohne dabei ein erhöhtes Infektionsrisiko zu haben. „Wir vermuten, dass die Leber bis zu einem gewissen Schädigungsgrad durch die Rekrutierung der Kupffer-Zell-ähnlichen Synzytien ihre Funktion aufrechterhält. Letztlich ist ja auch die Lebervernarbung ein evolutionär vorteilhafter Mechanismus, mit dem ein geschädigtes Organ das Überleben sichert. Daher macht es durchaus Sinn, dass sich auch das Immunsystem anpasst“, erklärt Dr. Peiseler, der unter anderem durch das Clinician Scientist Programm der Charité und des Berlin Institute of Health in der Charité (BIH) unterstützt wird.
Die aktuelle Untersuchung trägt zu einem besseren Verständnis bei, wie der wichtigste mikrobielle Filter des Körpers beim Entstehen von Lebererkrankungen funktioniert – eine Grundlage, um neuartige Therapien zu entwickeln. Die ursprünglichen Kupffer-Zellen verhalten sich durch den fehlenden Kontakt mit der Umgebung nicht mehr wie Immunzellen der Leber. Es wäre also denkbar, ihren Identitäts- und damit Funktionsverlust zu verhindern. Auch ist jetzt bekannt, auf welche Weise die Leber auf krankhafte Veränderungen reagiert. Diesen Prozess zu fördern, könnte Patient:innen schützen. Denn eine verbesserte mikrobielle Filterfunktion senkt das Risiko, an einer Leberzirrhose zu versterben und kann den Zeitpunkt einer Lebertransplantation – die derzeit einzige Behandlungsmöglichkeit – hinauszögern.
Über die Studie
Die Untersuchungen wurden unter anderem ermöglicht durch die Deutsche Forschungsgemeinschaft (DFG), das Charité BIH Clinician Scientist Programm, den Schweizerischen Nationalfonds (SNF), das Canadian Institute of Health Research (CIHR) und das Canada Research Chairs Program.
Wissenschaftlicher Ansprechpartner:
Dr. Moritz Peiseler
Medizinische Klinik mit Schwerpunkt Hepatologie und Gastroenterologie
Campus Virchow-Klinikum
Charité – Universitätsmedizin Berlin
t: +49 30 450 630 117
Email: moritz.peiseler@charite.de
Originalpublikation:
*Peiseler M et al. Kupffer cell–like syncytia replenish resident macrophage function in the fibrotic liver. Science 2023 Sep 08. doi: 10.1126/science.abq5202
Weitere Informationen:
https://www.science.org/doi/10.1126/science.abq5202
https://hepatologie-gastroenterologie.charite.de/
https://cumming.ucalgary.ca/
Die semantisch ähnlichsten Pressemitteilungen im idw