Pflanzen optimieren Eisen-Aufnahme je nach pH-Wert des Bodens
Eisen ist ein essentieller Mikronährstoff für Pflanzen, der im Allgemeinen in größeren Mengen in der Erdkruste zu finden ist. Seine Verfügbarkeit für Pflanzen ist jedoch stark vom pH-Wert des Bodens abhängig. Leiden Pflanzen unter Eisenmangel, so setzten bestimmte Pflanzen Cumarine frei. Welche Art dieser kleinen sekundären Metaboliten hauptsächlich freigesetzt wird, hängt vom jeweiligen pH-Wert des Bodens ab. Ein Forschungsteam unter Führung des IPK Leibniz-Instituts hat am Beispiel der Modellpflanze Arabidopsis thaliana gezeigt, wie unterschiedliche Cumarine genutzt werden, um die Eisen-Aufnahme unter sauren und unter alkalischen Bedingungen zu maximieren.
Pflanzen haben grundsätzlich zwei unterschiedliche Aufnahmemechanismen, um den lebenswichtigen Nährstoff Eisen aus ihrem Umfeld zu gewinnen. Die Strategie hängt ab von der botanischen Klassifikation der Pflanzen. Bei der sogennnaten Strategie I müssen die Pflanzen das dreiwertige Eisen (Fe3+) zunächst in zweiwertiges Eisen (Fe2+) reduzieren. Nur dann kann Fe2+ als freies Ion von den Pflanzen aufgenommen werden. Diese Strategie ist bei Nicht-Poaceae Pflanzen wie Raps und der Modellpflanze Arabidopsis thaliana zu finden. Gräser, die zu den Poaceae gehören, verfolgen eine sogennnate Strategy II. Sie scheiden zunächst organische Verbindungen, sogenannte Chelatoren, aus, die nach der Bindung mit Fe3+ wieder aufgenommen werden können. Damit ist auch kein Reduktionsschritt erforderlich.
„Interessanterweise geben einige Strategie-I-Pflanzen durch ihre Wurzel auch Metaboliten in den Boden ab, wenn sie unter Fe-Mangel leiden. Bei einigen davon handelt es sich um Cumarine“, erklärt IPK-Wissenschaftler Dr. Ricardo Giehl, Co-Leiter der Arbeitsgruppe „Molekulare Pflanzenernährung“. Die physiologische Bedeutung dieser Cumarine sei jedoch noch nicht ausreichend geklärt.
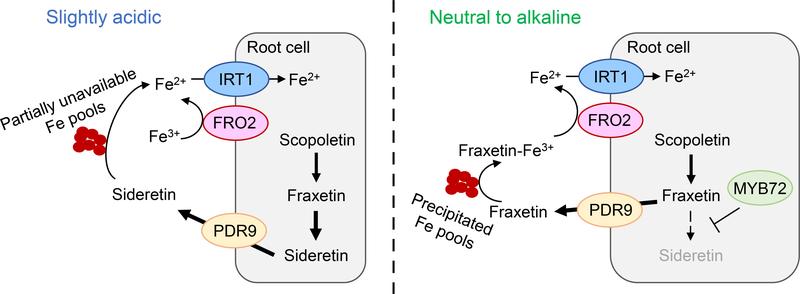
In ihrer Arbeit, die jetzt im Journal "The Plant Cell" veöffentlicht worden ist, konnten die Forscher zeigen, dass die Hauptfunktion von zwei durch Fe-Mangel induzierte Cumarinen weitgehend vom externen pH-Wert abhängt. Unter leicht sauren Bedingungen sind Cumarine, insbesondere Sideretin, für die Fe3+ Reduktion entscheidend. Hier wirkt Sideretin mit dem Enzym FERRIC REDUCTION OXIDASE 2 (FRO2) zusammen, um eine effiziente Fe2+ Aufnahme in die Wurzeln zu ermöglichen. Bei alkalischen pH-Werten wird die Synthese von Cumarinen gezielt verändert. Das Forschungsteam stellte fest, dass der Transkriptionsfaktor MYB72 eine Verschiebung des Cumarins Sideretin zu Fraxetin steuert. Bei einem alkalischem pH-Wert verliert Sideretin sowohl seine Fähigkeit, Fe3+ zu reduzieren als auch aus ausgefällten Quellen löslich zu machen, während Fraxetin unter solchen pH-Bedingungen eine hohe Fe3+-Mobilisierungskapazität beibehält. Daher anstatt Fe3+ direkt zu reduzieren, besteht die Hauptfunktion von Fraxetin darin, lösliche Fe(III)-Chelate für die FRO2-vermittelte Reduktion bereitzustellen.
„Unsere Studie zeigt, dass durch die Anpassung der Cumarin-Biosynthese die Pflanzen je nach vorherrschenden pH-Wert des Bodens spezifische Funktionen einstellen“, erläutert Dr. Ricardo Giehl. Unter leicht sauren Bedingungen bevorzugen die Pflanzen die Synthese des effizienteren Fe3+-Reduktionsmittels Sideretin, während sie bei alkalischen pH die Synthese auf Fraxetin ausrichten, das auch unter diese Bedingungen eine hohe Fe3+-Mobilisierungskapazität beibehält.
Mit ihrer Arbeit liefern die Forschenden wertvolle Einblicke in die Feinregulierung der Metaboliten-Biosynthese in Abhängigkeit von den Umweltbedingungen und helfen so zu verstehen, wie sich Pflanzen an unterschiedliche pH-Bedingungen im Boden anpassen. Damit eröffnen sie neue Möglichkeiten für eine gezielte Verbesserung der pflanzlichen Produktivität und Pflanzengesundheit unter variablem Bodenbedingungen.
Wissenschaftlicher Ansprechpartner:
Dr. Ricardo Giehl
Tel.: +49 39482 5293
giehl@ipk-gatersleben.de
Originalpublikation:
Paffrath et al. (2023): A major role of coumarin-dependent ferric iron reduction in strategy I-type iron acquisition in Arabidopsis. The Plant Cell. DOI: 10.1093/plcell/koad279
Ähnliche Pressemitteilungen im idw