Impfung mit überraschender Nebenwirkung: Schlafende Immunzellen werden geweckt
Bacillus Calmette-Guérin (BCG) ist eine der ältesten und weltweit meistverwendeten Impfungen. Sie schützt nicht nur gegen Tuberkulose, sondern reduziert auch das Risiko, sich mit verschiedenen anderen Erregern zu infizieren – dank eines Mechanismus, der als „trainierte Immunität“ bezeichnet wird. In einer neuen Studie, geleitet von Christoph Bock und Mihai Netea, konnte mittels epigenetischer Zellzuständen vorhergesagt werden, welchen Menschen von dem „Weckruf“ der BCG-Impfung an das angeborene Immunsystem profitieren. Diese Entdeckung trägt zur Entwicklung neuer Wirkstoffe bei, mit denen der Schutz der trainierten Immunität aufgebaut werden kann.
Der menschliche Körper wird von zwei großen Abwehrsystemen geschützt: Dem angeborenen Immunsystem, mit eingebauten Verteidigungsstrategien gegen häufige Merkmale von Bakterien und Viren, und dem erworbenen Immunsystem, welches ein detailliertes Gedächtnis und individuelle Abwehrmaßnahmen gegen Krankheitserreger aufbaut, mit denen ein Mensch im Laufe seines Lebens in Berührung kommt. Impfungen nutzen dies aus, indem sie dem erworbenen Immunsystem neue Erreger präsentieren, ohne dass man eine tatsächliche Infektion durchstehen muss. Damit haben Impfungen einen großen Beitrag für die menschliche Gesundheit geleistet, es bedarf jedoch für jeden Erreger einen eigens entwickelten Impfstoff.
Zusätzlicher Schutz vor Ansteckungen
Manche Impfstoffe unterrichten jedoch nicht nur das erworbene Immunsystem über einen spezifischen Erreger, sondern erhöhen darüber hinaus die generelle Wachsamkeit der angeborenen Immunzellen. Ein Beispiel dafür ist die BCG-Impfung: Sie führt nicht nur zur erworbenen Immunität gegen Tuberkulosebakterien, sondern reduziert auch die Säuglingssterblichkeit, unabhängig von ihrer Schutzwirkung gegen Tuberkulose. Diese Beobachtung kann durch das Konzept der „trainierten Immunität“ erklärt werden, also der Idee, dass angeborene Immunzellen zwischen einem ruhenden und einem wachsamen Zustand wechseln können – letzterer lässt sie effektiver gegen Infektionen kämpfen.
Eine solche trainierte Immunität gezielt durch Wirkstoffe oder Impfungen aufzubauen, könnte zusätzlichen Schutz in Zeiten erhöhter Ansteckungsgefahr bieten, etwa nach schwerwiegenden Operationen oder während zukünftiger Pandemien, noch bevor maßgeschneiderte Impfungen verfügbar sind. Die Ausprägung der trainierten Immunität kann sich individuell jedoch stark unterscheiden, und bisher konnte man sich nicht erklären, weshalb manche Menschen davon profitieren und andere nicht.
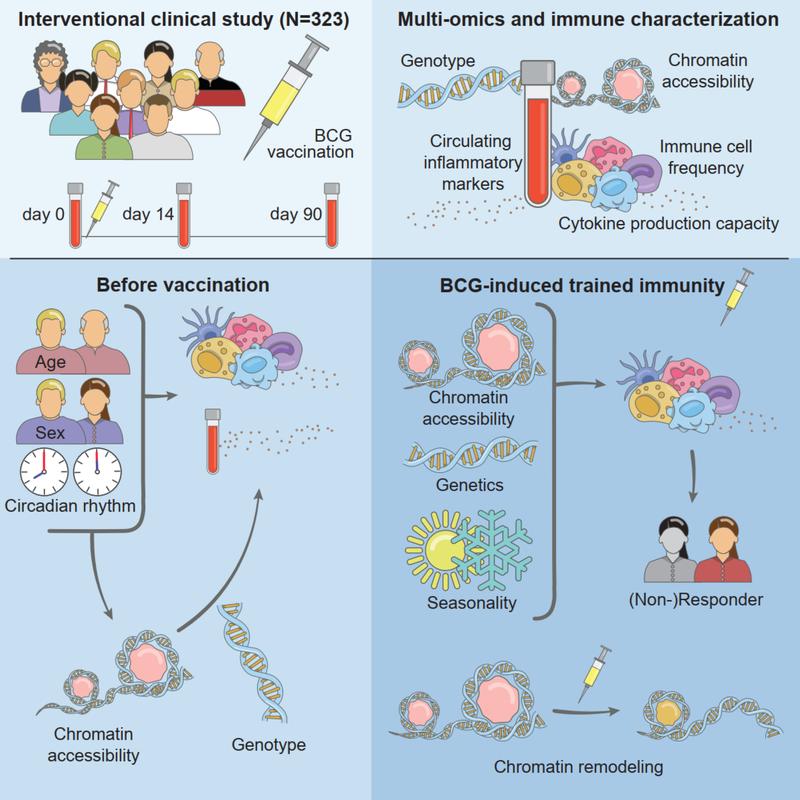
Um diese Frage zu beantworten hat ein Team von Forschenden, geleitet von Mihai Netea (Radboud University Medical Center) und Christoph Bock (CeMM & Medizinische Universität Wien) 323 gesunde ProbandInnen mit BCG geimpft und die Effekte auf deren Immunsystem untersucht. Bei jenen Probanden mit einem angeborenen Immunsystem im Ruhezustand war die von BCG induzierte trainierte Immunität am stärksten ausgeprägt. Dies spiegelte sich in einem charakteristischen epigenetischen Zustand der Immunzellen wider, mit dem sich dieser Effekt vorhersagen ließ (Moorlag SJCFM, Folkman L, ter Horst R, Krausgruber T, et al. Immunity. 2024).
Nicht jede Immunzelle braucht Training
213 der untersuchten ProbandInnen stellten sich als sogenannte „Responder“ heraus, bei denen sich die trainierte Immunität ausprägte, während 73 „Non-Responder“ keine trainierte Immunität zeigten. Dies wurde anhand der Produktionsrate von Entzündungs-Mediatoren 90 Tage nach der BCG-Impfung ermittelt – ein Zeitpunkt, an dem die akute Reaktion darauf abgeklungen ist, eine trainierte Immunität jedoch weiter bestehen sollte. Die Responder produzierten vor der Impfung weniger Mediatoren und hatten eher ruhende angeborene Immunzellen als die Non-Responder. Mit anderen Worten: Die Wachsamkeit des Immunsystem, welches die BCG-Impfung in den Respondern auslöste, war bei den Non-Respondern bereits vorhanden.
Sowohl genetische als auch Umweltfaktoren tragen zu diesen unterschiedlichen Voraussetzungen bei, am interessantesten waren für die Forschenden jedoch die verschiedenen epigenetischen Zustände der Immunzellen, welche durch die Zugänglichkeit des Chromatins – dem Komplex aus DNA und Proteinen im Zellkern, der Gene leichter oder schwerer ablesbar macht – vermittelt werden. Epigenetische Zustände spiegeln die regulatorische Plastizität einer Zelle und ihre Fähigkeit, schnell auf Umweltveränderungen zu reagieren, wider, was sie zu hervorragenden Kandidaten für die Regulierung der trainierten Immunität macht. Tatsächlich öffnete sich bei Respondern nach der BCG-Impfung das Chromatin bei jenen Genen, die für die angeborene Immunität verantwortlich sind. Bei Non-Respondern war das Chromatin in diesen Regionen dagegen schon vor der Impfung offen und wurde auch danach nicht weiter geöffnet.
Diese Ergebnisse zeigen, wie epigenetische Zustände den Immunzellen erlauben, zwischen verschiedenen Graden an immunologischer Wachsamkeit zu wechseln. Dies trägt vermutlich dazu bei, die Immunaktivität für den Schutz vor Erregern gegen unnötige und schädliche Immunreaktionen auszubalancieren.
Narbenbildung und Säuglingssterblichkeit
Die Studie erklärt auch einen zuvor beobachteten Zusammenhang zwischen der Narbenbildung an der Stelle einer BCG-Impfung auf der Haut und einer niedrigeren Säuglingssterblichkeit. Die Narbenbildung an der Injektionsstelle wurde bisher als ein Zeichen für starke Immunantwort gedeutet. Das Team der Forschenden kommt dagegen zu einem anderen Schluss: Es scheint, dass die Narbenbildung auf ein starkes Immunsystem vor der Impfung hindeutet, wodurch man besser gegen Infektionen, die unabhängig von der BCG-Impfung auftreten, geschützt sein könnte – was auch die Säuglingssterblichkeit reduziert.
Neben neuen Erkenntnissen über die Immunbiologie und die Rolle der Epigenetik liefert die Studie auch neue Möglichkeiten für die Entwicklung medizinischer Anwendungen. „Wir werden in Zukunft eine neue Art von Medikamenten sehen, bei denen man ein ruhendes Immunsystem gezielt aufweckt“, so Mihai Netea. „Ältere Menschen könnten dadurch ihr Immunsystem vor einem geplantem Spitalsaufenthalt stärken, man könnte vielleicht auch das unterdrückte Immunsystem von Krebspatienten damit wieder reaktivieren. Mehrere Unternehmen forschen bereits an Wegen, um die trainierte Immunität ohne den Einsatz von BCG-Impfstoffen zu erreichen.“
Für solche Vorhaben liefert die neue Studie wichtige Informationen. Erstens, weil die Analyse der biologischen Reaktionswege, die mit der Bildung einer trainierten Immunität zusammenhängen, neue therapeutische Wirkstoffziele enthüllen kann. Zweitens zeigt die Studie, dass solche Wirkstoffe nur bei jenen Individuen wirksam wären, die ein schwaches angeborenes Immunsystem besitzen, was durch ihren Chromatinstatus oder ihr immunologisches Profil nachweisen lässt. Drittens scheint es nur ein geringes Risiko einer übermäßigen Aktivierung des angeborenen Immunsystems zu geben, da bei jenen Probanden mit einem starken angeborenen Immunsystem keine weitere Aktvierung zu verzeichnen war.
„Unsere Studie zeigt die enge Verbindung zwischen den epigenetischen Zellzuständen und der trainierten Immunität“, fasst Christoph Bock die Ergebnisse zusammen. „Das erlaubt dem menschlichen Körper zwischen einem wachsamen und einem ruhendem Immunsystem hin und her zu wechseln. Dies ist ein Prozess, der individuell sehr unterschiedlich sein kann und im Rahmen einer Präzisionsmedizin zur molekularen Prävention und gezielten Therapie von Krankheiten genutzt werden könnte.“
+++
Die Studie “Multi-omics analysis of innate and adaptive responses to BCG vaccination reveals epigenetic cell states that predict trained immunity” erschien in der Zeitschrift Immunity am 9. Januar 2024. DOI: 10.1016/j.immuni.2023.12.005
Autor:innen: Moorlag SJCFM*, Folkman L*, ter Horst R*, Krausgruber T*, Barreca D, Schuster LC, Fife V, Matzaraki V, Li W, Reichl S, Mourits VP, Koeken VACM, de Bree LCJ, Dijkstra H, Lemmers H, van Cranenbroek B, van Rijssen E, Koenen HJPM, Joosten I, Xu C-J, Li Y, Joosten LAB, van Crevel R, Netea MG#, Bock C# (* Erstautoren # Letztautoren)
Förderungen: Diese Studie wurde durch einen Marie Skłodowska-Curie Actions Individual Fellowship (L.F.), einen EMBO Postdoctoral Fellowship (R.t.H.), den Europäischen Forschungsrat (M.G.N. und C.B.), das Forschungs- und Innovationsprogramm Horizont 2020 der Europäischen Union (M.G.N. und L.A.B.J.), die Niederländische Organisation für wissenschaftliche Forschung (M.G.N.) sowie durch zwei Sonderforschungsbereiche des Österreichischen Wissenschaftsfonds FWF (C.B.) unterstützt.
Christoph Bock ist Forschungsgruppenleiter am CeMM Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften und Professor für [Bio]Medizinische Informatik an der Medizinischen Universität Wien. Er ist wissenschaftlicher Koordinator der Biomedical Sequencing Facility am CeMM, Mitglied des Organisationskomitees des Human Cell Atlas, Fellow des European Lab for Learning and Intelligent Systems (ELLIS) und Mitbegründer eines in Wien ansässigen Start-up-Unternehmens (Myllia Biotechnology). Christoph Bock hat bedeutende Forschungsförderungen und Wissenschaftspreise erhalten, darunter einen ERC Starting Grant (2016-2021), einen ERC Consolidator Grant (2021-2026), die Otto-Hahn-Medaille der Max-Planck-Gesellschaft (2009), den Overton Prize der International Society for Computational Biology (2017) und den Erwin-Schrödinger-Preis der Österreichischen Akademie der Wissenschaften (2022).
Mihai Netea leitet die Abteilung für experimentelle Medizin an der Klinik für Innere Medizin des Radboud University Medical Center in Nijmegen (Niederlande). Er ist ein wissenschaftlicher Gründer der Biotech-Start-ups Trained Therapeutix Discovery und Lemba sowie des Biotech-Inkubators Biotrip. Sein Hauptinteresse gilt dem Verständnis von Gedächtnismerkmalen der angeborenen Immunität (trainierte Immunität) und hat bedeutende Fördermittel wie ERC Consolidator (2012–2017) und ERC Advanced (2019–2024) Grants erhalten. Er ist gewählter Fellow der Infectious Diseases Society of America, Träger des van Loghem Preises der Niederländischen Gesellschaft für Immunologie und des Spinoza-Preises (2016). Seit 2016 ist er Mitglied der Königlichen Akademie der Wissenschaften der Niederlande (KNAW).
Das CeMM Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften ist eine internationale, unabhängige und interdisziplinäre Forschungseinrichtung für molekulare Medizin unter wissenschaftlicher Leitung von Giulio Superti-Furga. Das CeMM orientiert sich an den medizinischen Erfordernissen und integriert Grundlagenforschung sowie klinische Expertise, um innovative diagnostische und therapeutische Ansätze für eine Präzisionsmedizin zu entwickeln. Die Forschungsschwerpunkte sind Krebs, Entzündungen, Stoffwechsel- und Immunstörungen, sowie seltene Erkrankungen.
Das Forschungsgebäude des Institutes befindet sich am Campus der Medizinischen Universität und des Allgemeinen Krankenhauses Wien.
www.cemm.at
Die Medizinische Universität Wien ist eine der traditionsreichsten medizinischen Ausbildungs- und Forschungsstätten Europas. Mit rund 8.000 Studierenden ist sie heute die größte medizinische Ausbildungsstätte im deutschsprachigen Raum. Mit 6.000 MitarbeiterInnen, 30 Universitätskliniken und zwei klinischen Instituten, 12 medizintheoretischen Zentren und zahlreichen hochspezialisierten Laboratorien zählt sie auch zu den bedeutendsten Spitzenforschungsinstitutionen Europas im biomedizinischen Bereich.
www.meduniwien.ac.at
Das Radboud University Medical Center in Nijmegen ist eines von sieben akademischen medizinischen Zentren in den Niederlanden. Mit ca. 11.100 Mitarbeitern bietet es Patientenversorgung, Lehre und Forschung. Ein wesentliches Ziel ist die biomedizinische, translationale und klinischer Forschung zur Verbesserung der Gesundheit des Menschen. Besondere Stärken liegen in den medizinischen Biowissenschaften und der klinischen Praxis.
www.radboudumc.nl
Für Rückfragen wenden Sie sich bitte an:
Stefan Bernhardt
PR & Communications Manager
CeMM
Research Center for Molecular Medicine
of the Austrian Academy of Sciences
Lazarettgasse 14, AKH BT 25.3
1090 Vienna, Austria
Phone +43-1/40160-70 056
Mobile +43 660 3408133
sbernhardt@cemm.at
www.cemm.at
Wissenschaftlicher Ansprechpartner:
Christoph Bock, CeMM-PI: cbock@cemm.oeaw.ac.at ; https://www.biomedical-sequencing.org/
Originalpublikation:
Multi-omics analysis of innate and adaptive responses to BCG vaccination reveals epigenetic cell states that predict trained immunity. Immunity, 9. Januar 2024. DOI: 10.1016/j.immuni.2023.12.005
Ähnliche Pressemitteilungen im idw