Erkennen, angreifen, ausschalten: Wie Seepferdchen-förmige Toxine Insekten töten
Dortmunder Max Planck-Forschende enthüllen erstmals die detaillierte Struktur des Bakterientoxins Mcf1
Auch Insekten werden regelmäßig von krankheitserregenden Bakterien befallen. Diese setzen dabei Toxine frei, um ihre Wirte zu töten. Das Bakterium Photorhabdus luminescens beispielsweise pumpt Insektenlarven mit dem tödlichen Toxin "Makes caterpillars floppy 1" (Mcf1) voll, wodurch die Larven erst erschlaffen und dann sterben. Doch wie Mcf1 seine verheerende Wirkung entfaltet, war bisher ein Rätsel. Forschenden unter der Leitung von Stefan Raunser, Direktor am Max-Planck-Institut für molekulare Physiologie in Dortmund, ist es nun mit Hilfe der Kryo-Elektronenmikroskopie (Kryo-EM) und biochemischer Tests erstmals gelungen, die Mcf1-Struktur zu charakterisieren und einen molekularen Mechanismus für die Wirkung des Toxins vorzuschlagen. Das Wissen um diesen detaillierten Prozess ist sehr hilfreich bei der Entwicklung neuartiger Biopestizide. Diese könnten den Einsatz kaum spezifischer chemischer Pestizide mit schädlichen Nebenwirkungen für das Ökösystem reduzieren.
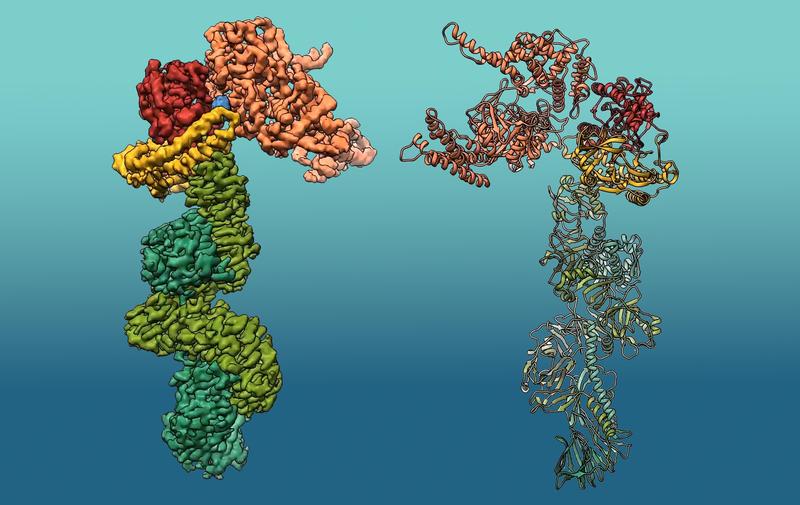
"Unsere Arbeit stellt die allererste Strukturstudie über dieses Toxin dar", erklärt Erstautor Alexander Belyy. Größe und Aufbau des Proteins, bestehend aus mehreren Modulen mit unterschiedlichen Funktionen, haben die Forschenden lange Zeit vor eine schier unlösbare Herausforderung gestellt. „Ein Jahrzehnt Arbeit steckt in diesem Projekt. Entscheidend für die Auflösung dieser Struktur war am Ende der Einsatz unserer hochmodernen Kryo-EM-Ausrüstung und unserer Rechenleistung", sagt Stefan Raunser.
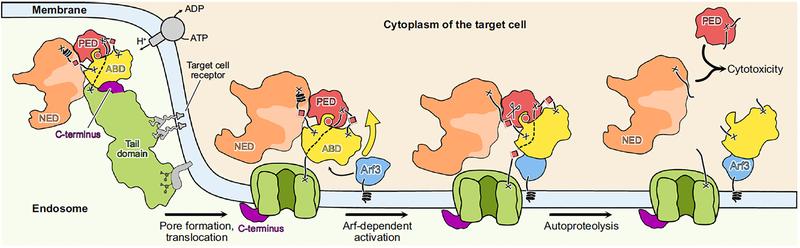
Die Kryo-EM ermöglicht den Forschenden, 3D-Bilder eines Proteins mit nahezu atomarer Auflösung zu erhalten, in diesem Fall mit 3,6 Ångström. Details, 200.000 Mal kleiner als die Breite eines menschlichen Haares, können so beobachtet werden. So konnten die Forschenden zeigen, dass die Struktur von Mcf1 der Form eines Seepferdchens ähnelt: Der Kopf ist angefüllt mit der giftigen Ladung, während der Schwanzbereich an Zielzellen anhaften kann. Nachdem die Bakterien das Toxin im Wirtsinsekt freigesetzt haben, identifizieren drei Domänen in der Schwanzregion die Membran der Zielzelle und binden daran. Eine andere Schwanz-Domäne schleust dann den Kopf durch die Membran in das Zytoplasma der Zelle ein. Dort interagiert der Kopf mit lokalen Wirtsproteinen, um die Freisetzung von zwei Giftstoffen zu stimulieren. Die tödlichen Gifte stören die Aktivität lebenswichtiger Proteine, was zum Tod der Zelle führt. Innerhalb von 24 Stunden ist der Wirt tot.
Neue organische Schädlingsbekämpfungsmittel
Interessanterweise fanden die Forschenden heraus, dass der modulare Aufbau des Schwanzes und die ersten Schritte der Mcf1-Vergiftung den Toxinen von Clostridioides difficile stark ähneln. Dieser menschliche Krankheitserreger ist verantwortlich für jährlich mehr als 120.000 Krankenhausaufenthalte in Europa. "Unsere Studie, die ursprünglich auf die Verbesserung von Biopestiziden abzielte, wird sich auch auf das Verständnis menschlicher Krankheiten auswirken", fügt Philipp Heilen, Co-Erstautor der Studie, hinzu.
In Zukunft wollen die MPI-Forschenden im molekularen Detail aufklären, wie die Giftstoffe von Mcf1 zum Zelltod führen. "Dieses neue Wissen ermöglicht auch die Entwicklung hochspezifischer insektizider Toxine", sagt Stefan Raunser und deutet damit eine weitere künftige Forschungsrichtung an: die Entwicklung neuer Toxinvarianten für die ökologische Schädlingsbekämpfung.
Originalpublikation:
Belyy A, Heilen P, Hagel P, Hofnagel O, Raunser S (2023). Structure and activation mechanism of the Makes caterpillars floppy 1 toxin. Nat Commun.
Doi: 10.1038/s41564-023-01571-z.
Weitere Informationen:
https://www.mpi-dortmund.mpg.de/aktuelles/bakterien-toxine-toeten-insekten
Ähnliche Pressemitteilungen im idw