Entzündungsfördernde Immunzellen bei Morbus Crohn entdeckt – und umprogrammiert
Forschende des Bosch Health Campus und der Mayo Clinic in Rochester (USA) haben eine bisher unbekannte Untergruppe von T-Zellen identifiziert, die bei Morbus Crohn eine entzündungsfördernde Wirkung haben. Zudem haben die Wissenschaftler:innen eine Methode entwickelt, diese Zellen mit einem epigenetisch wirkenden Medikament erfolgreich umzuprogrammieren. Da entzündliche Darmerkrankungen das Darmkrebsrisiko erhöhen, bieten die Erkenntnisse großes Potenzial, Therapien mit weitreichender Wirkung zu entwickeln. Die Studie ist im renommierten Fachjournal „Gastroenterology“ erschienen.
Stuttgart, 8. Februar 2024 – Bei der chronisch-entzündlichen Darmerkrankung Morbus Crohn ist die Konzentration von Immunzellen an den entzündeten Stellen erhöht. Auch sogenannte regulatorische T-Zellen (Tregs) reichern sich dort an, doch tragen sie hier, anders als üblich, nicht zur Bekämpfung der Entzündung bei. Nun haben Forschende des Bosch Health Campus und der Mayo Clinic in Rochester (USA) eine Erklärung dafür: Sie fanden eine Untergruppe der Tregs, deren Zellidentität dahingehend verändert ist, dass sie Entzündungen befördern statt hemmen.
Für die Studie „The FOXP3+ Pro-inflammatory T cell: A Potential Therapeutic Target in Crohn’s Disease“ hat die Forschungsgruppe um PD Dr. Robyn Laura Kosinsky vom Robert Bosch Centrum für Tumorerkrankungen (RBCT) am Bosch Health Campus die Methode der Einzelzell-Sequenzierung verfeinert. Bei der Methode werden Gewebeproben in Einzelzellen zerlegt, sodass diese individuell bestimmt und identifiziert werden können.
Die Ursache liegt bei den Signalwegen
Üblicherweise enthalten solche Gewebeproben sehr viele verschiedene Zelltypen, sodass der Anteil der regulatorischen T-Zellen zu gering ist, um differenzierte Aussagen über sie zu treffen. Deshalb haben die Wissenschaftler:innen das Gewebe von 13 Morbus-Crohn-Patient:innen mithilfe des Oberflächenmarkers CD4 so aufgereinigt, dass ausschließlich spezifische Zelltypen, unter anderem Treg-Zellen, übrig blieben. Bei der Untersuchung dieser Proben fanden die Forschenden die neuartige Untergruppe von Tregs. „Wir konnten beobachten, dass bei ihnen diverse inflammations-assoziierte Signalwege hochreguliert sind, wodurch ihr entzündungsförderndes Profil entsteht“, erklärt die Molekularbiologin und Krebsforscherin PD Dr. Robyn Laura Kosinsky.
Um diese Signale einzudämmen, behandelten Kosinsky und ihre Kolleg:innen die Zellen in Kulturen mit dem in den USA zugelassenen epigenetisch wirkenden Medikament Vorinostat, das die pro-inflammatorische Funktion unterdrückt. Mit Erfolg: Den Forschenden gelang es, die entzündungsfördernden Tregs durch die Hemmung bestimmter Enzyme, sogenannter Histon-Deacetylasen, umzuprogrammieren, sodass sich die Funktion der Zellen wieder normalisierte.
Das Medikament hilft, Lücken im Darmepithel zu schließen
Darüber hinaus kultivierten die Forschenden die entzündlichen Treg-Zellen mit sogenannten humanen Colon-Organoiden, künstlich erzeugten organähnlichen Mikrostrukturen. Ohne Behandlung war das Gewebe durchlässiger als üblich. Ein Phänomen, das den Forschenden bekannt ist: Auch bei Morbus-Crohn-Patient:innen wurde bereits ein durchlässiges Darmepithel beschrieben. Die Lücken entstehen durch einen Verlust der sogenannten Tight Junctions, als der engen Zellverbindungen. So können Bakterien leichter eindringen und Entzündungsprozesse fördern. Auch hier zeigte das Medikament Wirkung: Hatten die Forschenden die Treg-Zellen mit Vorinostat behandelt, verschwanden die Lücken.
„Durch unsere Entdeckung der entzündungsfördernden Treg-Population und die Möglichkeit, diese pharmakologisch umzuprogrammieren, könnten sich neue Möglichkeiten ergeben, Patient:innen mit chronisch entzündlichen Darmerkrankungen zielgerichteter zu behandeln und ihre Krankheitslast zu mindern“, sagt Kosinsky. Aus ihrer Sicht ist es lohnend zu überprüfen, ob die entdeckte Treg-Zell-Population auch bei anderen Erkrankungen des Darms vorhanden ist und ob sie bei der Entstehung von Darmkrebs eine Rolle spielt.
Bildunterschrift
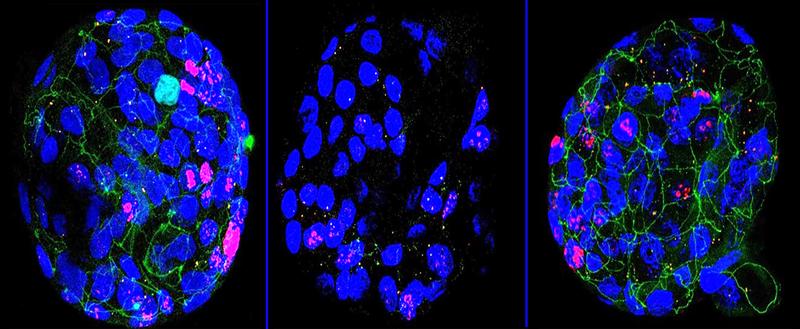
Für die Studie wurden humane Colon-Organoide (blau) mit drei verschiedenen Treg-Zellkulturen kultiviert. Unter Kontrollbedingungen mit normalen Tregs (links) sind „Tight Junctions“ (grün) zwischen den Epithelzellen ersichtlich, die für eine enge Verbindung zwischen den Zellen sorgen. Mit entzündlichen Tregs sind kaum Tight Junctions vorhanden, was für eine hohe Durchlässigkeit des Epithels spricht (Mitte). Werden die Treg-Zellen zuvor mit Vorinostat behandelt, kann die Durchlässigkeit behoben werden (rechts).
________________________________________________________________________
Über den Bosch Health Campus
Der Bosch Health Campus vereint alle Institutionen und Förderaktivitäten der Robert Bosch Stiftung im Bereich Gesundheit mit den vier Säulen Behandeln, Forschen, Bilden und Fördern. Mit seinen interdisziplinär vernetzten Einrichtungen und mehr als 3000 Mitarbeitenden hat es sich der Bosch Health Campus zur Aufgabe gemacht, innovative Lösungen für die großen Herausforderungen des Gesundheitswesens anzubieten.
Zum Bosch Health Campus gehören das Robert Bosch Krankenhaus, das Dr. Margarete Fischer-Bosch Institut für Klinische Pharmakologie, das Robert Bosch Centrum für Tumorerkrankungen, das Robert Bosch Centrum für Integrative Medizin und Gesundheit, das Institut für Geschichte der Medizin, die Koordinierungsstelle Telemedizin Baden-Württemberg, das Irmgard Bosch Bildungszentrum sowie das Robert Bosch Centrum für Innovationen im Gesundheitswesen.
Mehr unter https://www.bosch-health-campus.de/de
________________________________________________________________________
Kontakt
Bosch Health Campus GmbH
Presse- und Öffentlichkeitsarbeit
Cornelia Varwig
presse@bosch-health-campus.com
Tel. +49 711 8101-3638
Originalpublikation:
https://www.sciencedirect.com/science/article/abs/pii/S001650852400009X
Ähnliche Pressemitteilungen im idw