Insulin steuert Recycling von Zellkraftwerken
Das Hormon Insulin kontrolliert viele zelluläre Vorgänge und passt sie an die Energieversorgung des Körpers an. Dass zu den Insulin-gesteuerten Vorgängen auch die Qualitätskontrolle von Zellkraftwerken in Nervenzellen zählt, fand ein Team um Angelika Harbauer am Max-Planck-Institut für biologische Intelligenz nun heraus. Ist im Körper ausreichend Energie vorhanden, vereinfacht Insulin den Abbau von fehlerhaften Kraftwerken. Ist Energie knapp oder das Insulinsignal gestört, wird das Recycling unterbunden und die Mitochondrien werden weitergenutzt. Ein solcher Weiterbetrieb fehlerhafter Zellkraftwerke könnte sich auch auf Alterungsprozesse und neurologische Erkrankungen auswirken.
Nervenzellen stellen besondere Anforderungen an ihre Energieversorgung. Die weite Verzweigung der Zellen und ihr hoher Energiebedarf erfordern eine fein abgestimmte Steuerung der Zellkraftwerke in ihrem Inneren, den sogenannten Mitochondrien. Insbesondere in den langen Zellfortsätzen, den Axonen, müssen immer genügend funktionsfähige Mitochondrien vorhanden sein. Nur so können die Zellen die dort benötigte Energie für die Kommunikation mit ihren Nachbarn bereitstellen. Deshalb werden Mitochondrien auch bis an die entlegensten Stellen der Nervenzellen transportiert.
Die vorangegangene Forschung von Angelika Harbauer konnte zeigen, dass die Zellkraftwerke auf ihrer Reise durch die Nervenzellen den Bauplan des für sie wichtigen Proteins PINK1 mitnehmen. „PINK1 ist ein Schlüsselprotein, wenn es darum geht, nicht mehr korrekt funktionierende Mitochondrien aus dem Verkehr zu ziehen“, erklärt die Max-Planck-Forschungsgruppenleiterin. „Es kann ausgediente Mitochondrien für das Recycling markieren und wird daher durch die Zellen genau reguliert.“ Ohne diese Regulierung könnte es leicht zu einer Unterversorgung mit Mitochondrien kommen. Aber auch der Weiterbetrieb defekter Zellkraftwerke kann einer Nervenzelle schaden.
Ein Hormon mit vielfältigen Aufgaben
Wie sich nun herausstellte, ist auch das Hormon Insulin in die Qualitätskontrolle der Mitochondrien involviert. Insulin ist vorrangig für seine Funktion bekannt, die Zuckeraufnahme durch Zellen zu regulieren. Doch auch im Inneren der Zellen steuert das Hormon viele Vorgänge. Mit Hilfe von Insulin können die Arbeitsabläufe in den Zellen genau auf das momentane Energieangebot im Körper abgestimmt werden.
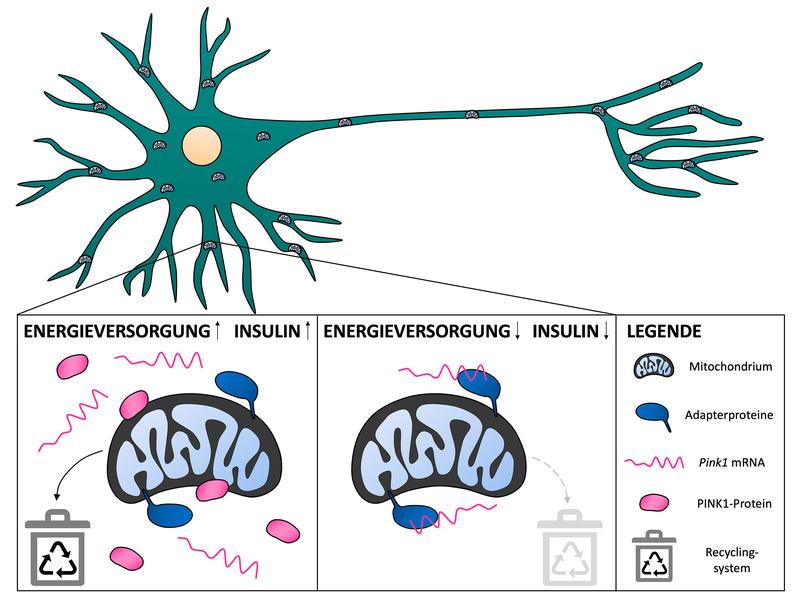
Im Falle des Mitochondrien-Recyclings funktioniert das folgendermaßen: Ist genügend Energie vorhanden, wird ein Signal vom Insulinrezeptor auf der Zelloberfläche zu den Mitochondrien weitergeleitet. Dort sind die PINK1-Baupläne als mRNA-Moleküle zwischengelagert. Beim Eintreffen des Insulinsignals werden sie freigegeben und die Zelle kann zusätzliches PINK1-Protein herstellen. Dieses sorgt dafür, dass defekte Mitochondrien effizient aussortiert werden. Herrscht hingegen Energieknappheit, oder fehlt das Signal des Insulinrezeptors, werden die Baupläne für PINK1 fest an die Mitochondrien gebunden. Das ermöglicht einerseits den Transport der Baupläne in die langen Zellfortsätze der Nervenzelle, verringert aber andererseits auch die Verfügbarkeit für die PINK1-Herstellung. Das Recycling von Mitochondrien wird verringert – auch wenn das zum Weiterbetrieb von beschädigten Kraftwerken führen kann.
„Wir hatten erwartet, dass die Bindung der mRNA-Moleküle an die Mitochondrien die PINK1-Produktion begünstigt“, sagt Tabitha Hees, Erstautorin der Studie. „Überraschenderweise ergaben unsere Experimente, dass das nicht der Fall ist. Offenbar ist es bei Energieknappheit für die Zellen günstiger, weniger PINK1 zu produzieren und möglicherweise defekte Mitochondrien weiter zu nutzen.
Gestörte Signalübertragung: Implikationen bei Erkrankungen und Alterungsprozessen
Eine ähnliche Situation tritt ein, wenn die Signalübertragung vom Insulinrezeptor zu den Mitochondrien aufgrund einer Erkrankung gestört ist. Das passiert nicht nur bei Diabetes, sondern wurde im Gehirn auch in Verbindung mit Alzheimer-Erkrankungen beobachtet. Zudem ist bekannt, dass eine ineffiziente Qualitätskontrolle der Mitochondrien zu verschiedenen neurodegenerativen Erkrankungen beitragen kann. „Unsere Beobachtungen fügen sich in unser immer besser werdendes Verständnis ein, wie die zelluläre Energieversorgung, Alterungsprozesse und Erkrankungen des Gehirns miteinander zusammenhängen“, sagt Angelika Harbauer.
Im nächsten Schritt möchten die Forschenden untersuchen, was genau mit den PINK1-Bauplänen passiert, sobald sie von den Mitochondrien in die Zelle freigegeben wurden, um neues PINK1-Protein zu produzieren. „Uns interessiert vor allem, wo die Produktion des PINK1-Proteins stattfindet, wenn nicht an den Mitochondrien, und wie das fertige Protein anschließend seinen Weg dorthin zurückfindet“, sagt Tabitha Hees. Denn erst wenn mithilfe der mRNA-Moleküle funktionsfähiges PINK1-Protein entsteht, kann das Mitochondrien-Recycling beginnen.
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Angelika Harbauer
Max-Planck-Forschungsgruppenleiterin
Max-Planck-Institut für biologische Intelligenz
E-Mail: angelika.harbauer@bi.mpg.de
Originalpublikation:
Insulin signaling regulates Pink1 mRNA localization via modulation of AMPK activity to support PINK1 function in neurons
J. Tabitha Hees, Simone Wanderoy, Jana Lindner, Marlena Helms, Hariharan Murali Mahadevan and Angelika B. Harbauer
Nature Metabolism, online 19 March 2024
DOI: 10.1038/s42255-024-01007-w
Weitere Informationen:
https://www.bi.mpg.de/harbauer/de - Webseite der Forschungsgruppe
Ähnliche Pressemitteilungen im idw