Abrupte epigenomische Alterung des Darms
Forscherteam vom Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut aus Jena (FLI), des Universitätsklinikums Jena und der Christian-Albrechts-Universität zu Kiel identifiziert schlagartige molekulare Veränderungen im Alternsprozess. Der jetzt in Nature Communications veröffentlichten Studie zufolge gibt es mindestens zwei epigenomische Umbrüche im Lebensverlauf des Darms einer männlichen Maus: einen während des Übergangs vom frühen zum mittleren Lebensalter (3-9 Monate) und einen während des Übergangs vom mittleren zum späten Lebensalter (15-24 Monate).
Jena/Kiel. DNA-Methylierungsdaten liefern äußerst genaue Altersprädiktoren, aber bisher ist wenig über die Dynamik dieses epigenomischen Biomarkers im Verlauf des Lebens bekannt. Ein Forscherteam des Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI), des Universitätsklinikums Jena (UKJ) und der Christian-Albrechts-Universität zu Kiel (CAU) um Dr. Maja Olecka, Dr. Alena van Bömmel, Prof. Christoph Kaleta, Dr. Christiane Frahm und Prof. Steve Hoffmann hat dazu beigetragen, diese Wissenslücke zu verkleinern.
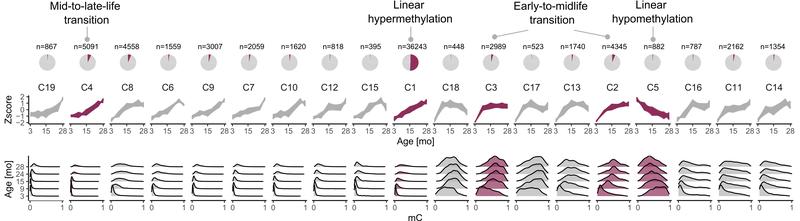
Die Bioinformatiker untersuchten die epigenetischen Muster (Methylierungstrajektorien) des männlichen Mauskolons zu verschiedenen Zeitpunkten des Alterns. Neben kontinuierlichen Methylierungsveränderungen konnten sie auch schlagartige Hypermethylierungsereignisse der DNA in spezifischen Lebensphasen nachweisen. Der jetzt in Nature Communications veröffentlichten Studie zufolge gibt es mindestens zwei epigenomische Umbrüche im Lebensverlauf des Darms einer männlichen Maus: einen während des Übergangs vom frühen zum mittleren Lebensalter (3-9 Monate) und einen während des Übergangs vom mittleren zum späten Lebensalter (15-24 Monate). Das Leben der Nagetiere kann somit ganz konkret in drei Stadien unterteilt werden.
Die Erkenntnisse bieten neue Perspektiven auf die Dynamik des Alterns. “Wir können den Alterungsprozess zumindest im Darm nicht mehr ausschließlich als kontinuierliche Anhäufung molekularer Veränderungen sehen, wie sie im Laufe des Lebens etwa durch verschiedene Umweltfaktoren und interne Prozesse im Körper auftreten können. Die Ergebnisse legen vielmehr nah, dass die Alterung durch eine schnelle und gezielte Umlegung bestimmter epigenomischer Schalter begleitet wird”, erklärt Dr. Alena van Bömmel, eine der beiden Erstautorinnen. Ihre Kollegin Dr. Maja Olecka ergänzt: “Vermutlich haben die von uns beschriebenen nichtlinearen Methylierungsänderungen einen funktionellen Einfluss auf das Organ. Gene, die von plötzlichen Veränderungen sowohl auf der Ebene der DNA-Methylierung als auch der Genexpression betroffen sind, spielen eine wichtige Rolle bei verschiedenen Aspekten der Gesundheit und Funktion des Dickdarms. Dazu zählen etwa Gene mit einer Bedeutung für das enterische Nervensystem, die Barrierefunktion des Darms und die Entwicklung von Dickdarmkrebs”.
Begleitend entwickelte das Forscherteam einen Uhr-artigen Klassifizierer namens STageR (STage of aging estimatoR). Mit ihm kann das epigenetische Stadium von Mäusen vorhergesagt werden. Der STageR unterscheidet sich von anderen epigenomischen Uhren insofern, als dass er auf nichtlinear veränderten DNA-Bereichen basiert. Er liefert der Alternsforschung damit eine weitere Methode zur Untersuchung des Epigenoms. Die Genauigkeit des STageRs wurde in einer separaten Gruppe von Mäusen sowie anhand öffentlich verfügbarer Daten bestätigt.
Die nächsten Schritte dieses Forschungsprojekts sind bereits ins Auge gefasst: “Die von uns entdeckten, nichtlinearen Methylierungsdynamiken sind ein spannender Ausgangspunkt für weitere Studien,” erklärt Steve Hoffmann. “Wir wollen nun prüfen, ob das Phänomen auch in anderen Geweben sichtbar ist."
Hintergrundinformationen
Das Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI) in Jena widmet sich seit 2004 der biomedizinischen Alternsforschung. Rund 350 Mitarbeiter aus ca. 40 Nationen forschen zu molekularen Mechanismen von Alternsprozessen und alternsbedingten Krankheiten. Näheres unter www.leibniz-fli.de.
Die Leibniz-Gemeinschaft verbindet 97 eigenständige Forschungseinrichtungen. Ihre Ausrichtung reicht von den Natur-, Ingenieur- und Umweltwissenschaften über die Wirtschafts-, Raum- und Sozialwissenschaften bis zu den Geisteswissenschaften. Leibniz-Institute widmen sich gesellschaftlich, ökonomisch und ökologisch relevanten Fragen. Sie betreiben erkenntnis- und anwendungsorientierte Forschung, auch in den übergreifenden Leibniz-Forschungsverbünden, sind oder unterhalten wissenschaftliche Infrastrukturen und bieten forschungsbasierte Dienstleistungen an. Die Leibniz-Gemeinschaft setzt Schwerpunkte im Wissenstransfer, vor allem mit den Leibniz-Forschungsmuseen. Sie berät und informiert Politik, Wissenschaft, Wirtschaft und Öffentlichkeit. Leibniz-Einrichtungen pflegen enge Kooperationen mit den Hochschulen - in Form der Leibniz-WissenschaftsCampi, mit der Industrie und anderen Partnern im In- und Ausland. Die Leibniz-Institute unterliegen einem transparenten und unabhängigen Begutachtungsverfahren. Aufgrund ihrer gesamtstaatlichen Bedeutung fördern Bund und Länder die Institute der Leibniz-Gemeinschaft gemeinsam. Die Leibniz-Institute beschäftigen rund 20.500 Personen, darunter 11.500 Wissenschaftlerinnen und Wissenschaftler. Das Finanzvolumen liegt bei 2 Milliarden Euro. (www.leibniz-gemeinschaft.de).
Originalpublikation:
Nonlinear DNA methylation trajectories in aging male mice
Maja Olecka*, Alena van Bömmel*, Lena Best, Madlen Haase, Silke Foerste, Konstantin Riege, Thomas Dost, Stefano Flor, Otto W. Witte, Sören Franzenburg, Marco Groth, Björn von Eyss, Christoph Kaleta*, Christiane Frahm* & Steve Hoffmann*
https://doi.org/10.1038/s41467-024-47316-2
Ähnliche Pressemitteilungen im idw