Einzigartige Eigenschaften von bisher unerforschtem Protein entdeckt
Forschungskollaboration zwischen Freiburg und Prag gelingt wissenschaftlicher Durchbruch im Verständnis der Zellteilung
Eine internationale Forschungskollaboration, geleitet von Prof. Dr. Robert Grosse (Centre for Integrative Biological Signalling Studies und Institut für klinische und experimentelle Pharmakologie und Toxikologie der Universität Freiburg), Dr. Libor Macurek (Institute of Molecular Genetics, Czech Academy of Sciences, Prag) und Dr. Zdenek Lansky (Institute of Biotechnology, Czech Academy of Sciences, Prag) hat einen neuen Mechanismus des Zusammenspiels zwischen Mikrotubuli und Aktin-Zytoskelett während der Zellteilung entschlüsselt und einzigartige Eigenschaften des bisher unerforschten Proteins FAM110A aufgedeckt. Dieser wissenschaftliche Durchbruch stärkt das Verständnis eines entscheidenden mikrobiologischen Prozesses, der auch im Zusammenhang mit der Entstehung von Entwicklungsstörungen und Krebs relevant ist. Die Studie wurde in der Fachzeitschrift Proceedings of the National Academy of Sciences veröffentlicht.
Die entscheidende Rolle von FAM110A in der korrekten Bildung von Spindelaktin
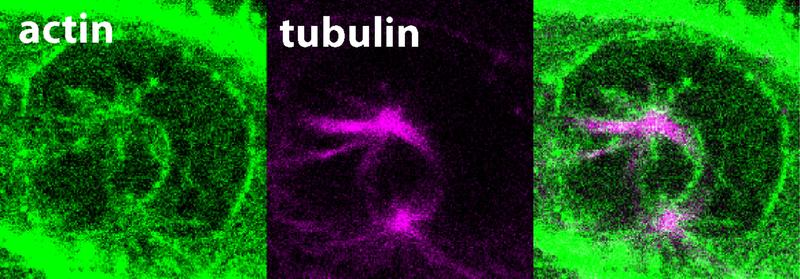
Eine präzise Aufteilung der genetischen Information auf Tochterzellen ist essentiell in allen Geweben unseres Körpers. Damit Entwicklungsanomalien verhindert werden, unterliegt dieser Prozess einer strengen zeitlichen und räumlichen Regulierung. Es ist seit Jahrzehnten bekannt, dass Chromosomen sich an eine bipolare Struktur namens mitotische Spindel anhängen, welche aus sogenannten Mikrotubuli besteht. Während die Mitose voranschreitet – der Prozess durch den sich eine Zelle in Nukleus und genetisches Material teilt um zwei identische Tochterzellen hervorzubringen, unter Sicherstellung einer gleichmäßigen Verteilung von Chromosomen – werden die an die mitotische Spindel angehängten Chromosomen entlang der Mikrotubuligleise zu den Tochterzellen gezogen. Bis vor Kurzem glaubten Wissenschaftler:innen, Aktinfilamente würden lediglich für den letzten Schritt der Tochterzellteilung benötigt und die Rolle des Aktinzytoskeletts während der Mitose ist über lange Zeit hinweg unbeachtet geblieben. In ihrer aktuellsten Studie konnte das Forschungsteam nun demonstrieren, dass das bislang unerforschte Protein FAM110A einzigartige Eigenschaften besitzt, die es ihm ermöglichen, Aktin und Mikrotubuli an gegenüberliegenden Enden – spezifisch an den Polen der mitotischen Spindeln – zu binden. Mikroskopische Analysen zeigten, dass sich um die Spindelpole herum hochdynamische Aktinfilamente bilden, die dem Wachstum der Spindelmikrotubuli vorausgehen und dieses steuern. In Abwesenheit von FAM110A war die ordnungsgemäße Bildung des Spindelaktins gestört, was wiederum zu einer erheblichen Beeinträchtigung der Chromosomentrennung führte. Die Studie weist somit auf eine entscheidende molekulare Verbindung zwischen den beiden primären Zytoskelett-Netzwerken während der Mitose hin. Dieser Durchbruch schafft Voraussetzungen für künftige Untersuchungen dazu, wie FAM110A und verwandte, in menschlichen Zellen vorkommende Proteine die Instabilität des Genoms und die Entstehung von Krebs verhindern.
Originalveröffentlichung: Cecilia Aquino Perez, Mahira Safaralizade, Roman Podhajecky, Hong Wang, Zdenek Lansky, Robert Grosse and Libor Macurek (2024): FAM110A promotes mitotic spindle formation by linking microtubules with actin cytoskeleton. In: Proceedings of the National Academy of Sciences.
DOI: https://doi.org/10.1073/pnas.2321647121
Prof. Dr. Robert Grosse ist Mitglied des Exzellenzclusters CIBSS – Centre for Integrative Biological Signalling Studies und Direktor der Abteilung I am Institut für experimentelle und klinische Pharmakologie an der medizinischen Fakultät der Universität Freiburg.
Diese Studie wurde unterstützt durch die Deutsche Forschungsgemeinschaft (DFG).
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Robert Grosse
Institut für Experimentelle und Klinische Pharmakologie und Toxikologie
Abteilung I
Tel.: 0761/203-5301
robert.grosse@pharmakol.uni-freiburg.de
https://www.pharmakologie.uni-freiburg.de/de
Originalpublikation:
https://doi.org/10.1073/pnas.2321647121
Die semantisch ähnlichsten Pressemitteilungen im idw