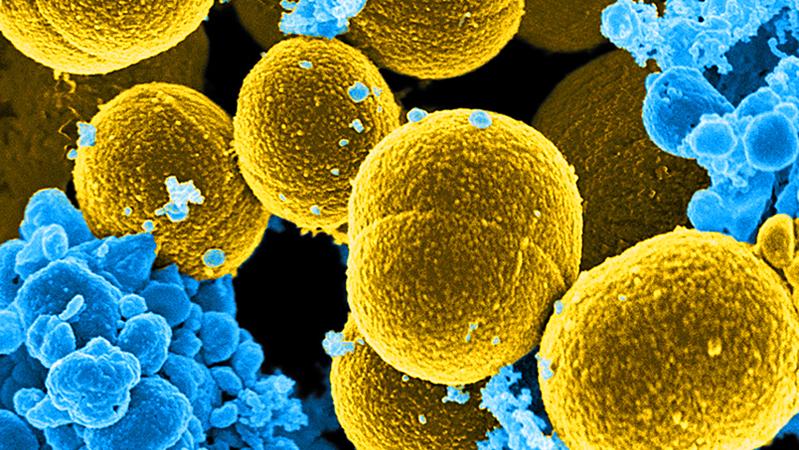
Phagenlysin-Wirkstoff HY-133 gegen Staphylococcus aureus: Start der klinischen Phase-I-„First-in-Human“-Studie
Die Substanz HY-133 wirkt spezifisch gegen Staphylococcus aureus, ein Bakterium, das im nasalen Mikrobiom etwa jedes dritten Menschen vorkommt. Die Besiedlung ist im normalen Leben harmlos, kann aber bei Operationen und Krankenhausaufenthalten zum Problem werden. Die klinische Phase-1-„First-in-Human“-Studie mit dem neuartigen Arzneimittelkandidaten zur Prüfung der Sicherheit, Verträglichkeit und Wirksamkeit begann am 10. Juli mit der Rekrutierung klinisch gesunder Freiwilliger, die positiv auf eine S. aureus-Besiedlung der Nase getestet wurden.
Das Bakterium Staphylococcus aureus ist bei etwa jedem dritten Menschen als Teil des Mikrobioms in der Nasenhöhle zu finden. Die Besiedlung ist im normalen Leben harmlos, kann aber bei Operationen und Krankenhausaufenthalten zum Problem werden. HY-133 – ein von der Firma HYpharm entwickelter und in Zusammenarbeit mit dem Deutschen Zentrum für Infektionsforschung (DZIF) und Universitäten in Tübingen, München, Münster und Greifswald für die klinische Prüfung vorbereiteter Wirkstoff – erhielt im März 2024 die Genehmigung für die Prüfung der Sicherheit, Verträglichkeit und Wirksamkeit in einer klinischen Phase-I-Studie. HY-133 soll die Besiedlung der Nase mit S. aureus, einschließlich Methicillin-resistenter S. aureus (MRSA)-Stämme, und damit das Risiko seiner klinischen Verbreitung sowohl im Patienten als auch im Krankenhausumfeld bekämpfen. Die Phase-1-„First-in-Human“-Studie mit dem neuartigen Arzneimittelkandidaten begann am 10. Juli mit der Rekrutierung klinisch gesunder Freiwilliger, die positiv auf eine S. aureus-Besiedlung der Nase getestet wurden.
Bakteriophagen – kurz: Phagen – sind Viren, die Bakterien gezielt abtöten können. Sie stellen eine potenziell wertvolle Ergänzung zur Antibiotikatherapie bei der gezielten Bekämpfung von Infektionskrankheiten dar. Bei dem neuartigen Wirkstoff HY-133 handelt es sich um ein Phagenlysin – ein Protein aus einem Phagen, das hochspezifisch Staphylococcus aureus-Bakterien einschließlich Methicillin-resistenter S. aureus (MRSA)-Stämme angreift und diese auflöst. Das lysierende Protein wurde künstlich hergestellt und als „Designer-Protein“ unter dem Namen HY-133 optimiert.
„Etwa 30-40% der Menschen sind natürlicherweise in der Nasenhöhle mit einem Staphylococcus aureus-Stamm besiedelt“, erklärt Prof. Karsten Becker, mikrobiologischer Facharzt an der Universitätsmedizin Greifswald und einer der wissenschaftlichen Leiter der Studie.
„Kommt es bei einem Krankenhausaufenthalt zu einer Infektion mit diesem Erreger – beispielsweise einer Sepsis oder Wundinfektion – ist zu einem sehr hohen Prozentsatz genau dieser Stamm aus der Nasenhöhle dafür verantwortlich. Handelt es sich um einen MRSA-Stamm, wird eine antibiotische Therapie durch dessen Multiresistenz zusätzlich erschwert. Hinzu kommt ein hoher krankenhaushygienischer Aufwand, um eine Ausbreitung eines MRSA-Stammes im Krankenhaus zu verhindern. Um diese Gefahren zu verringern, braucht es ein wirksames Mittel, um den Erreger aus der Nasenhöhle zu entfernen. Mit der bisher vorrangig eingesetzten Nasensalbe erreicht man eine Erregerbeseitigung jedoch erst nach mehrfacher Gabe über mehrere Tage und als antibiotikahaltiges Mittel unterliegt es auch selbst einer Resistenzentwicklung“, fährt Prof. Becker fort.
Die Testung des neuen Wirkstoffs wurde seit dem Jahr 2010 von den DZIF-Wissenschaftlern Prof. Becker an der Universitätsmedizin Greifswald (vormals am Universitätsklinikum Münster), und dem Mikrobiologen und DZIF-Vorstandsmitglied Prof. Andreas Peschel an der Universität Tübingen in Kooperation mit Hyglos (der Vorgängerorganisation von HYpharm) vorangetrieben – seit 2012 im Rahmen des DZIF-Forschungsbereichs Antibiotika-resistente und mit dem Gesundheitswesen assoziierte bakterielle Infektionen. Aufgrund der erfolgreichen präklinischen Entwicklung des Wirkstoffs wurde im März 2024 von der Arzneimittelbehörde die Genehmigung für eine erste klinische Studie im Menschen erteilt.
„Wir konnten belegen, dass HY-133 innerhalb von kürzester Zeit, das heißt in wenigen Minuten, in der Lage ist, Staphylococcus aureus-Zellen zu zerstören und das völlig unabhängig davon, ob es sich um einen MRSA-Stamm handelt oder nicht“, betont Prof. Becker und ergänzt: „Besonders vorteilhaft ist dabei, dass das Phagenlysin nicht auf andere Mikroorganismen wirkt und somit die sogenannte 'Normalflora' – wir sagen heute Mikrobiota – in der Nasenhöhle nicht beeinträchtigen wird.“ „Auch das wollen wir mit der klinischen Studie untermauern“, fügt Prof. Peschel hinzu.
Für die klinische Prüfung wurde die Substanz von den DZIF-Wissenschaftlern Prof. Evgeny A. Idelevich und Prof. Becker vom Friedrich Löffler-Institut für Medizinische Mikrobiologie in Greifswald und Prof. Peschel in Tübingen vorbereitet. Mehr als fünf Millionen Euro wurden dafür im DZIF für die Herstellung nach den Grundsätzen der Guten Herstellungspraxis (Good Manufacturing Practice, GMP), präklinische Prüfung und Entwicklung einer stabilen Formulierung an der Ludwig-Maximilians-Universität München (Prof. Dr. Gerhard Winter) bis hin zur Durchführung der klinischen Phase I bereitgestellt.
Unter der Verantwortung von Dr. med. Sebastian Volc begann am 10. Juli 2024 am Studienzentrum Immundermatologie am Universitätsklinikum Tübingen (Studien-Sponsor) die Phase-I-klinische Studie. In der randomisierten, doppel-verblindeten, Placebo-kontrollierten „First-In-Human“-Studie mit Einzeldosen und Mehrfachdosen wird die Sicherheit, Verträglichkeit und Wirksamkeit von HY-133 untersucht. Zusätzlich wird die Auswirkung von HY-133 auf das natürliche Mikrobiom der Nase getestet. Die Studie startete nun mit der Rekrutierung der ersten Probanden – klinisch gesunde Freiwillige, die positiv auf eine Nasenbesiedlung mit S. aureus getestet wurden aber keine Erkrankungssymptome aufweisen.
Wissenschaftlicher Ansprechpartner:
Prof. Dr Andreas Peschel
Eberhard Karls Universität Tübingen
Andreas.Peschel@uni-tuebingen.de
Prof. Dr Karsten Becker
Universitätsmedizin Greifswald
karsten.becker@med.uni-greifswald.de
Weitere Informationen:
https://www.dzif.de/de/phagenlysin-wirkstoff-hy-133-start-der-klinischen-phase-i-first-human-studie-zur-eliminierung-von Pressemitteilung des Deutschen Zentrums für Infektionsforschung (DZIF) vom 29. Juli 2024
https://www.dzif.de/de/der-wirkstoff-hy-133-hat-die-genehmigung-fuer-die-klinische-phase-i-erhalten Pressemitteilung des Deutschen Zentrums für Infektionsforschung (DZIF) vom 11. Juni 2024
Ähnliche Pressemitteilungen im idw