Neue Erkenntnisse: Akute myeloische Leukämie und Chemotherapie schädigen langfristig das Nervensystem im Knochenmark
Forschende um Tatyana Grinenko und Martin Bornhäuser von der TU Dresden haben eine neue Methode entwickelt, um die 3D-Architektur des menschlichen Knochenmarks sichtbar zu machen. Sie untersuchten Veränderungen im Knochenmark durch akute myeloische Leukämie, einem tödlichen Blutkrebs, und entdeckten eine Schädigung der sympathischen Nervenfasern bei AML-Patienten, die durch eine Chemotherapie verstärkt wird. Da das sympathische Nervensystem die Blutbildung steuert, kann seine Schädigung die Produktion von Blutzellen beeinträchtigen. Eine nervenschützende Therapie könnte eine neue Richtung in der Therapie eröffnen. Das Projekt wurde von der Wilhelm Sander-Stiftung mit 125.000 € gefördert.
Blutbildende Stammzellen sind eine seltene Zellart des Knochenmarks (BM), aus der alle Blutzellen hervorgehen: Rote Blutkörperchen, Blutplättchen, Lymphozyten und myeloische Zellen. Stammzellen spielen eine zentrale Rolle bei der Produktion von Blutzellen und der Aufrechterhaltung eines gesunden Blutkreislaufs. Eine Störung dieses Prozesses kann schwerwiegende Folgen haben, wie zum Beispiel bei der akuten myeloischen Leukämie (AML), einer Krebserkrankung, die die Blutzellproduktion stark beeinträchtigt.
Bei der AML führen Mutationen in blutbildenden Stammzellen oder anderen unreifen blutbildenden Zellen im Knochenmark dazu, dass die Blutzellproduktion außer Kontrolle gerät. Die abnormen oder mutierten Zellen können nicht normal funktionieren und keine reifen Blutzellen bilden. Sie sammeln sich im Knochenmark und im Blut an und verdrängen die normalen Zellen.
Das Knochenmark ist ein komplexer, gut organisierter Raum mit verschiedenen Arten von Zellen und Strukturen wie blutbildenden Stammzellen, reiferen Blutzellen, Knochenzellen, Gefäßen, Nerven und anderen Zelltypen. Das Zusammenspiel aller Bestandteile des Knochenmarks gewährleistet die ununterbrochene Produktion aller Arten von Blutzellen. Anormale Leukämiezellen können jedoch die Kontrolle übernehmen und das Gleichgewicht im System so verändern, dass es für das Knochenmark schwierig wird, gesunde Blutzellen zu produzieren. Darüber hinaus können Krebszellen sogar andere Zellen umprogrammieren, um ihr Wachstum zu unterstützen. Daher ist es für die Entwicklung wirksamer Krebstherapien wichtig zu verstehen, wie Leukämiezellen die Umgebung des Knochenmarks verändern.
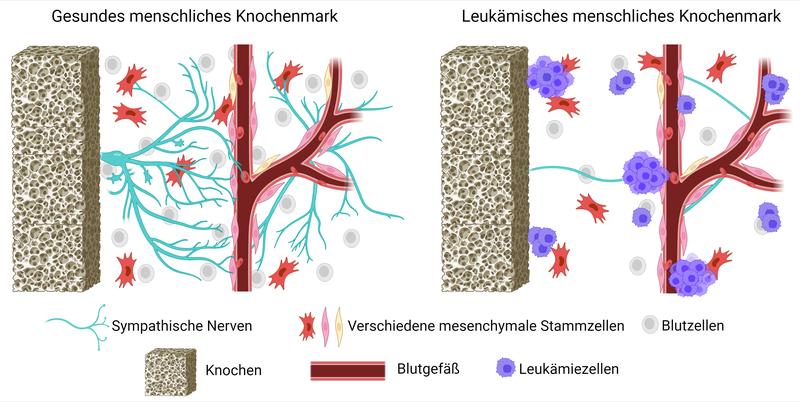
Die meisten Studien über gesundes und leukämisches Knochenmark wurden an Mausmodellen durchgeführt. Verschiedene Forschungsteams haben gezeigt, dass das sympathische Nervensystem viele Prozesse regulieren kann, darunter die ausgewogene Produktion von Blutzellen, die Zellwanderung im Körper, die Wiederherstellung des Blutkreislaufs nach Stress und das Wachstum von Krebszellen. Trotz der detaillierten Charakterisierung des Knochenmark-Milieus der Maus (murines BM-Milieu) ist das menschliche Knochenmark noch unzureichend erforscht und es muss geklärt werden, ob alle Komponenten des Maus-Knochenmarks auch für den Menschen relevant sind. Dieser Mangel an wichtigen Informationen über die intakte menschliche Knochenmark-Mikroumgebung inspirierte die Forschung an der Medizinischen Fakultät der Technischen Universität Dresden. Die Forschenden sammelten Biopsieproben von Gesunden und AML-Betroffenen am Universitätsklinikum Carl Gustav Carus und visualisierten mit Hilfe modernster Mikroskopie erstmals die gesunde und leukämische menschliche Knochenmarks-Mikroumgebung in 3D.
Das Team unter der Leitung von Prof. Tatyana Grinenko und Prof. Martin Bornhäuser fand eine dramatische Verringerung der funktionellen sympathischen Nervenfasern im Knochenmark von AML-Betroffenen. Durch die Chemotherapie wurden die Nerven im Knochenmark weiter zerstört. Zudem erholten sich die funktionsfähigen sympathischen Nerven im Knochenmark auch sieben, bzw. zwölf Monate nach der Behandlung nicht. Die Forschenden entdeckten damit die anhaltende Wirkung von invasivem Leukämiewachstum und Chemotherapie auf die sympathische Nervenkomponente des menschlichen Knochenmarks. Eine Schädigung der Knochenmarksnerven kann zu einer langfristigen Funktionsstörung des Blutsystems führen und die vollständige Genesung nach einer zytotoxischen Leukämiebehandlung verlangsamen oder unterbrechen (eine zytotoxische Leukämiebehandlung beinhaltet den Einsatz von Medikamenten, die Krebszellen abtöten oder ihr Wachstum hemmen, kann aber auch gesunde Zellen im Knochenmark schädigen). Insgesamt eröffnen diese Ergebnisse eine neue Richtung für die Behandlung von AML-Betroffenen durch den Schutz oder die Wiederherstellung der Nerven im Knochenmark. Die Forschenden arbeiten daran, die Mechanismen der Nervenschädigung zu identifizieren, um die Wirksamkeit der Leukämietherapie zu verbessern.
(3.513 Zeichen inkl. Leerzeichen)
* Die in diesem Text verwendeten Genderbegriffe vertreten alle Geschlechtsformen.
Wilhelm Sander-Stiftung: Partnerin der Krebsforschung
Die Wilhelm Sander-Stiftung hat das Forschungsprojekt mit 125.000 € über eine Förderperiode unterstützt. Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 280 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz ausbezahlt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen Unternehmers hervor, der 1973 verstorben ist.
Kontakt
Konstanze Adam
Wilhelm Sander-Stiftung
Presse- und Öffentlichkeitsarbeit & Stiftungskommunikation
Tel.: +49 (0) 89 544187-0
E-Mail: adam@sanst.de
Medizinische Fakultät Carl Gustav Carus der Technischen Universität Dresden
Die Medizinische Fakultät Carl Gustav Carus hat sich auf die Forschung in den Bereichen Onkologie, Metabolismus sowie neurologische und psychiatrische Erkrankungen spezialisiert. Innerhalb dieser Schwerpunkte sind die Themen Degeneration und Regeneration, Bildgebung und Technologieentwicklung, Immunologie und Entzündungen sowie Prävention und Versorgungsforschung von besonderem Interesse. Internationalität ist eine Voraussetzung für Spitzenforschung – die Dresdner Hochschulmedizin lebt dieses Konzept mit Mitarbeitern aus mehr als 90 Nationen und zahlreichen Kooperationen mit Forschern und Teams aus aller Welt.
Kontakt
Stephan Wiegand
Öffentlichkeitsarbeit
Medizinische Fakultät Carl Gustav Carus der Technischen Universität Dresden
Fetscherstr. 74
01307 Dresden
Tel.: +49 (351) 458-19389
E-Mail: stephan.wiegand@uniklinikum-dresden.de
Wissenschaftlicher Ansprechpartner:
Prof. Tatyana Grinenko & Prof. Martin Bornhäuser
Technische Universität Dresden
Medizinische Fakultät Carl Gustav Carus
Fetscherstraße 74
01307 Dresden
Tel.: +49 15751307379
E-Mail: Tatyana.grinenko@uniklinikum-dresden.de
Originalpublikation:
Kovtun I., von Bonin M., Ibneeva L., Frimmel J., Middeke J M., Kunadt D., Heberling L., Wobus M., Bornhäuser M. und Grinenko T. Profound sympathetic neuropathy in the bone marrow of patients with acute myeloid leukemia. Leukemia 38, 393–397 (2024). Doi: 10.1038/s41375-023-02104-7
Weitere Informationen:
http://www.wilhelm-sander-stiftung.de
http://www.linkedin.com/company/wilhelm-sander-stiftung/
http://tu-dresden.de/med/
https://twitter.com/Medizin_TUD
Ähnliche Pressemitteilungen im idw