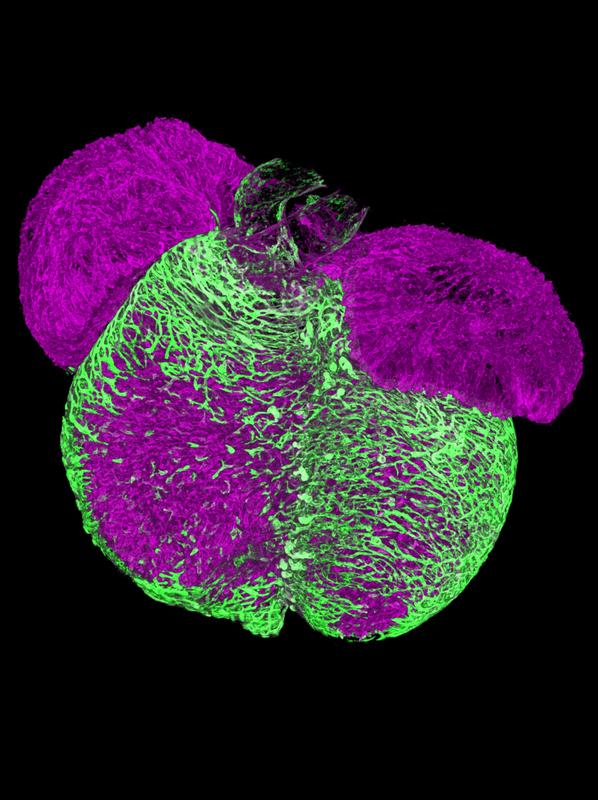
Wie das Herz Arterien bildet
Ein Team um Holger Gerhardt und Norbert Hübner vom Max Delbrück Center hat herausgefunden, wie sich neue Arterien bilden. Das könnte Therapien zur Regeneration des Herzmuskels nach einem Infarkt oder Schlaganfall verbessern. Die Ergebnisse wurden in „Circulation Research“ veröffentlicht.
Über welchen Mechanismus sich neue Arterien im Herzen bilden, hat ein Team unter Leitung von Dr. Elena Cano aus der Arbeitsgruppe „Integrative Vaskuläre Biologie“ von Professor Holger Gerhardt am Max Delbrück Center in Berlin entschlüsselt. Die in „Circulation Research“ publizierte Studie schließt eine wichtige Lücke in unserem bisherigen Verständnis zur Entstehung von Herzkranzgefäßen. Sie könnte dazu beitragen, Schäden am Herzmuskel nach einem Herzinfarkt oder Schlaganfall besser zu behandeln. Beides gehört weltweit zu den Hauptursachen für Tod und Behinderung. Das Deutsche Zentrum für Herz-Kreislauf-Forschung (DZHK) hat die Arbeit unterstützt.
Durch einen Herzinfarkt oder Schlaganfall kann Herzmuskelgewebe absterben. Infolgedessen verschlechtert sich die Blutversorgung des Herzens, was zu einer dauerhaften Schädigung führt. Obwohl ein Teil des Gewebes dank neuer Blutgefäße spontan heilen kann, reicht das häufig nicht aus, um die Blutversorgung vollständig wiederherzustellen. Derzeit konzentrieren sich Therapien auf die Symptome und darauf, das Fortschreiten der Herzerkrankung zu verlangsamen.
Forscher*innen haben verschiedene Methoden getestet, um neue Blutgefäße in geschädigtem Herzgewebe wachsen zu lassen. Aber bislang gelang es ihnen nicht, ein stabiles, ausgereiftes Gefäßnetzwerk zu etablieren, das die Herzfunktion verbessert, sagt Cano. Ein großes Hindernis war vor allem, dass wir die vielschichtigen molekularen, zellulären und strukturellen Signale, die Gefäßzellen nutzen, um ein hierarchisches Blutgefäßnetzwerk aufzubauen, noch nicht gut genug verstehen.
Einzelzell-Sequenzierung von präarteriellen Zellen
Cano untersuchte, wie Gewebe Gefäße ausbilden – und entdeckte dabei in ihren Proben eine Art präarterielle Zelle, die offenbar eine wichtige Rolle beim Wachstum neuer Arterien spielt. Andere Forscher*innen hatten diese präarteriellen Zellen bereits beschrieben. Cano wollte sie jedoch mit einer neuen Technologie untersuchen.
Mithilfe der Einzelzell-Sequenzierung analysierte das Forschungsteam, welche Teile des Erbguts Herzzellen von Mäusen in verschiedenen Stadien der Entwicklung gerade ablasen. Die Forscher*innen konnten zeigen, dass sich diese präarteriellen Herzzellen aus „tip cells“ (Zellen an der Spitze) entwickeln. Das sind spezialisierte Zellen, die Umwelthinweise wahrnehmen, um wachsende Gefäße in bestimmte Richtungen zu lenken. Das Team belegte diese Ergebnisse zusätzlich durch eine 3D-Kartierung in Raum und Zeit. Darüber hinaus wiesen sie nach, dass diese präarteriellen Zellen bereits „markiert“ waren, um sich zu arteriellen Zellen zu entwickeln, was der aktuellen Lehrmeinung zur arteriellen Entwicklung widerspricht.
Bisher hatte man angenommen, dass neue Arterien ihre charakteristischen Eigenschaften, wie Länge und Durchmesser, ausschließlich auf Grundlage mechanischer Reize ausbilden – etwa aufgrund der Geschwindigkeit der durch sie fließenden Flüssigkeit. „Diese Studie zeigt jedoch, dass präarterielle Zellen bereits Eigenschaften von Arterien aufweisen, bevor überhaupt Flüssigkeit durch sie fließt“, sagt Cano.
Die Forscher*innen analysierten zudem Ergebnisse von Einzelzelluntersuchungen neu, die von Wissenschaftler*innen im Vereinigten Königreich zu menschlichem Embryonalherzgewebe veröffentlicht hatten. Diese verglichen sie mit ihren eigenen Maus-Daten von durch Infarkt geschädigtem Herzgewebe. Dabei stellten sie fest, dass sich neue Arterien im menschlichen Embryonalgewebe durch denselben Mechanismus bildeten wie nach einer Schädigung durch einen Herzinfarkt bei Mäusen. „Wir zeigen, dass dieser Mechanismus nicht nur während der Entwicklung bei Mäusen und Menschen bestehen. Er bleibt während des gesamten Lebens erhalten und wird nach einem Herzinfarkt aktiviert“, sagt Cano.
Neue Behandlungsmöglichkeiten
Wer versteht, wie sich Herzkranzgefäße normalerweise bilden und regenerieren, könne auch Behandlungen entwickeln, die diese regenerativen Prozesse stimulieren und möglicherweise Herzmuskelschäden rückgängig machen, sagt Cano.
„Jetzt wissen wir, dass nicht nur der Blutfluss vaskuläre Endothelzellen dazu anregt, sich in Arterien zu verwandeln, sondern dass auch Spitzenzellen zu präarteriellen Zellen und schließlich in Arterien zu werden“, sagt Gerhardt. „Überraschenderweise besitzen nicht alle Spitzenzellen die Fähigkeit, Arterien zu bilden. Das eröffnet die Möglichkeit, den Zellbestand für therapeutische Zwecke selektiv zu vergrößern.“
„Das ist ein Schritt nach vorne“, fügt Cano hinzu. „Es handelt sich um einen neuen Mechanismus, den wir möglicherweise während der Regeneration anregen können. Dann können wir sehen, ob sich neue Arterien für eine optimale Wiederherstellung der Blutversorgung bilden lassen.“
Max Delbrück Center
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 70 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organ-übergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das Max Delbrück Center fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am Max Delbrück Center arbeiten 1800 Menschen. Finanziert wird das 1992 gegründete Max Delbrück Center zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin. www.mdc-berlin.de
Wissenschaftlicher Ansprechpartner:
Prof. Holger Gerhardt
Leiter der Arbeitsgruppe „Integrative vaskuläre Biologie“
Max Delbrück Center
Holger.Gerhardt@mdc-berlin.de
Originalpublikation:
DOI:10.1161/CIRCRESAHA.124.324868
Weitere Informationen:
https://www.mdc-berlin.de/de/gerhardt-Arbeitsgruppe von Holger Gerhardt
https://www.mdc-berlin.de/de/huebner#t-nachrichten-Arbeitsgruppe von Norbert Hübner
https://www.mdc-berlin.de/de/news/news/wenn-neue-adern-spriessen-Porträt über Holger Gerhardt
Die semantisch ähnlichsten Pressemitteilungen im idw