Innovativer Katalysator erzeugt mit Strom Methan
Forschende der Universitäten Bonn und Montreal haben einen neuartigen Katalysator entwickelt. Sie erzeugten damit aus Kohlendioxid und Wasser mit Hilfe von Strom Methan, und das mit hoher Effizienz. Methan eignet sich beispielsweise zum Beheizen von Wohnungen oder als Ausgangsstoff für die chemische Industrie. Es ist Hauptbestandteil von Erdgas. Wird es mit Hilfe von grünem Strom hergestellt, ist es dagegen weitgehend klimaneutral. Die Einsichten aus dem Modellsystem lassen sich auf großtechnische Katalysatoren übertragen. Zudem lassen sie sich auch für die Herstellung anderer wichtiger chemischer Verbindungen nutzen. Die Studie ist im Fachjournal Nature Chemistry erschienen.
Viele chemische Reaktionen benötigen Energie, um abzulaufen. Man kann diese zum Beispiel zuführen, indem man die Reaktionspartner erhitzt oder unter starken Druck setzt. „Wir nutzen dagegen als treibende Kraft Elektrizität“, erklärt Prof. Dr. Nikolay Kornienko. „Wenn wir klimafreundlich erzeugten Strom verwenden, können wir auf diesem Wege beispielsweise Methan herstellen, das nicht zur Erderwärmung beiträgt.“
Der Wissenschaftler ist kürzlich von der Universität Montreal an das Institut für Anorganische Chemie der Universität Bonn gewechselt. Die aktuelle Studie hat er noch in Kanada begonnen und dann in seiner neuen Heimat zum Abschluss gebracht. „Die Herstellung von Methan - chemisch: CH4 - ist insofern herausfordernd, als dass wir dazu ein Gas mit einer Flüssigkeit reagieren lassen müssen“, sagt er.
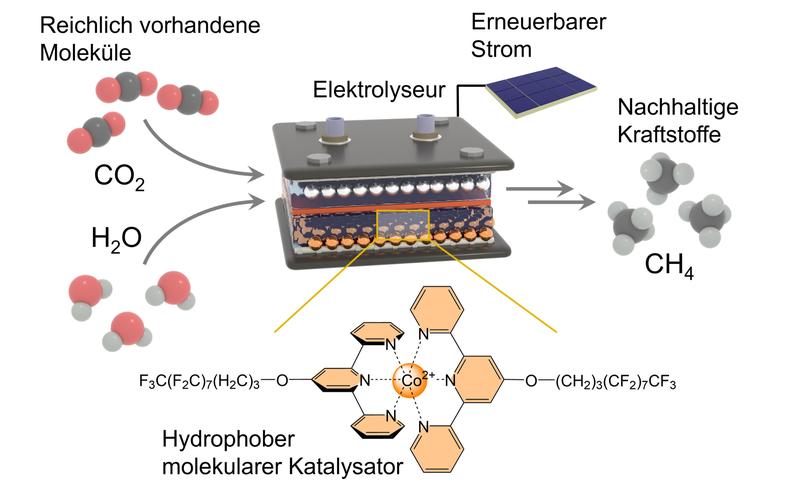
Die Rede ist von Kohlendioxid (CO2) und Wasser (H2O). Die Forschenden nutzten eine sogenannte Gasdiffusions-Elektrode, um diese beiden Partner zusammenzubringen. Bei der Reaktion müssen darin die beiden Sauerstoff-Atome (chemisches Kürzel O) vom Kohlenstoff-Atom (C) abgetrennt und durch vier Wasserstoff-Atome (H) ersetzt werden. Der Wasserstoff stammt dabei aus dem Wasser.
Nebenreaktionen verhindern
Das Problem dabei ist, dass das Wasser eigentlich viel lieber eine andere Reaktion eingehen würde: Beim Anlegen einer Spannung zersetzt es sich zu Wasserstoff und Sauerstoff. „Das ist eine Konkurrenz-Reaktion, die wir ausschließen müssen“, betont Kornienkos Mitarbeiter Morgan McKee, der einen großen Teil der Experimente durchgeführt hat. „Andernfalls würde sie dafür sorgen, dass kein Methan entsteht. Wir müssen also verhindern, dass Wasser in Kontakt zur Elektrode gerät. Gleichzeitig benötigen wir es aber als Reaktionspartner.“
Hier kommt der neu entwickelte Katalysator ins Spiel, der auf die Elektrode aufgebracht wird. Er sorgt vor allem dafür, dass die Reaktion von Kohlendioxid zu Methan bereitwilliger und schneller abläuft. Das macht er mit seinem sogenannten aktiven Zentrum: Damit hält er das Kohlendioxid fest; gleichzeitig schwächt er - vereinfacht gesagt - die Bindungen zwischen dem Kohlenstoff-Atom und den beiden Sauerstoff-Atomen.
Im nächsten Schritt werden diese sukzessive durch vier Wasserstoff-Atome ersetzt. Dazu benötigt der Katalysator Wasser. Allerdings muss er es gleichzeitig auf Abstand halten, um unerwünschte Nebenreaktionen zu verhindern. „Um das zu erreichen, haben wir lange Molekülketten an das aktive Zentrum gebunden“, erklärt Prof. Kornienko, der auch Mitglied im Transdisziplinären Forschungsbereich „Matter“ an der Universität Bonn ist. „Diese sind chemisch so aufgebaut, dass sie Wasser abstoßen - wir sagen auch: sie sind hydrophob.“
Wasserfürchtende Molekülketten
Der Fachbegriff stammt aus dem Griechischen und bedeutet „das Wasser fürchtend“. Die Seitenketten halten die H2O-Moleküle also einerseits vom aktiven Zentrum und der Elektrode fern. Zugleich dienen sie aber als eine Art Transportband: Bildlich gesprochen, entreißen sie Wassermolekülen Wasserstoff-Atome und schaffen diese zum aktiven Zentrum, wo sie mit dem Kohlenstoff-Atom reagieren. In der Summe entsteht so in mehreren Schritten aus dem CO2 das CH4.
Die Effizienz beträgt dabei mehr als 80 Prozent; bei der Reaktion entstehen also wenig unerwünschte Nebenprodukte. Dennoch eignet sich der Katalysator nicht für die Herstellung von Methan in großem Maßstab. „Die Reaktionsprinzipien, die wir in ihm verwirklicht haben, lassen sich aber auch in anderen Katalysatormaterialien realisieren, die sich großtechnisch einsetzen lassen“, sagt Kornienko.
Als Anwendungsgebiet sieht er nicht nur die Methan-Produktion. Noch lukrativer sei vermutlich die Herstellung von anderen chemischen Verbindungen. Dazu zählt beispielsweise Ethylen, das als Ausgangsstoff für viele Kunststoffe dient. Die neue Katalyse-Methode könnte mittelfristig also womöglich auch die Plastik-Produktion umweltfreundlicher machen.
Beteiligte Institutionen und Förderung:
An der Studie waren die Universitäten Bonn, Montreal (Kanada), Swansea (Wales), Bayreuth, Oulu (Finnland), Hohenheim, die FU Berlin und das Synchroton SOLEIL in Saint-Aubin (Frankreich) beteiligt. Die Studie wurde durch das Natural Sciences and Engineering Research Council of Canada (NSERC), das Engineering and Physical Sciences Research Council (EPSRC), das Higher Education Funding Council for Wales (HEFCW) sowie das Erasmus+-Programm der EU gefördert.
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Nikolay Kornienko
Institut für Anorganische Chemie der Universität Bonn
Tel. +49 176 60999819
E-Mail: nkornien@uni-bonn.de
Originalpublikation:
Morgan McKee et. al.: Hydrophobic molecular assembly at the gas-liquid-solid interface drives highly selective CO2 electromethanation; Nature Chemistry; DOI: 10.1038/s41557-024-01650-6, URL: https://www.nature.com/articles/s41557-024-01650-6
Die semantisch ähnlichsten Pressemitteilungen im idw