3D-Strukturen von Biomolekülen – „Wörterbücher“ machen fluoreszenzbasierte Daten zugänglich
Physikalische Chemie: Publikation in Nature Methods
Ein Forschungsteam aus Deutschland und den USA unter Leitung der Heinrich-Heine-Universität Düsseldorf (HHU) hat eine Datenbeschreibung entwickelt, die Ergebnisse aus Fluoreszenzmessungen für die Struktur- und Dynamikmodellierung großer Biomoleküle bereitstellen kann. Die Autoren erläutern in der Fachzeitschrift Nature Methods, dass so erstmals andere Forschende durch Datenbanken auf fluoreszenzbasierende integrative Strukturmodelle und deren Dynamik zugreifen können. Experimentbasierte Trainingsdaten für die nächste Generation von KI-Werkzeugen für die dynamische Strukturmodellierung werden so bereitgestellt.
Proteine und Nukleinsäuren sind zentrale Bausteine des Lebens in allen Organismen. Diese Biomoleküle setzen sich aus vielen einzelnen Bausteinen zusammen, bei Proteinen zum Beispiel aus Aminosäuren. Wenn die einzelnen Bausteine in den Zellen zusammengefügt werden, entstehen die Biomoleküle als komplexe, dreidimensionale Strukturen. Deren konkrete Form ist durch die Konfiguration und Kräfte zwischen den Bausteinen bestimmt. Um aber die Funktion der Biomoleküle zu verstehen, ist es wichtig, neben deren dreidimensionaler Struktur auch die Anzahl verschiedener Strukturzustände und die Austauschdynamik zwischen diesen zu berücksichtigen.
Es war lange Zeit sehr komplex und aufwändig, die 3D-Struktur von Biomolekülen mithilfe klassischer biophysikalischer Methoden zu bestimmen. Um diese Arbeit Schritt für Schritt zu vereinfachen und zu systematisieren, werden seit 1971 alle diese dreidimensionalen Strukturen in der „Protein Data Bank“ (PDB) [Link: https://www.rcsb.org] gesammelt. Diese mehr als 220.000 Strukturen nutzen KI-basierte Werkzeuge wie etwa „AlphaFold“ – für deren Entwicklung in diesem Jahr der Chemienobelpreis vergeben wurde – als Trainingsdaten für neuronale Netzwerke. Die KI-Systeme treffen heute schon gute Vorhersagen biomolekularer Strukturen. Die Werkzeuge können aber wegen fehlender experimenteller Daten derzeit keine Dynamik vorhersagen.
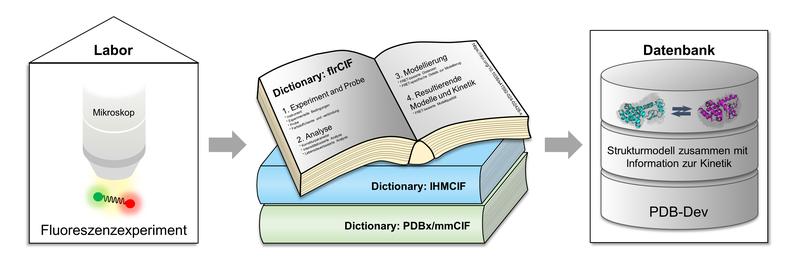
Daher ist es wichtig, leistungsfähige experimentelle Methoden wie zum Beispiel die Fluoreszenzspektroskopie einzusetzen, die kombinierte Informationen über die Dynamik und Struktur komplexer Biomoleküle liefern. Bei Fluoreszenzexperimenten werden bestimmte interessante Teile der Biomoleküle mit kleinen Farbstoffmoleküle markiert, die bei äußerer Anregung aufleuchten und damit ihre Positionen verraten. Integrative Modellierungsansätze kombinieren solche experimentellen Daten mit computergestützten Methoden, um eine höhere strukturelle Auflösung zu erreichen und die Dynamik zu berücksichtigen.
Dr. Christian Hanke, Postdoc am HHU-Institut für Molekulare Physikalische Chemie und Erstautor des in Nature Methods erschienenen Artikels, betont: „Fluoreszenzexperimente liefern detaillierte Informationen, die sie zu einer hervorragenden Datenquelle für die integrative Modellierung machen. Damit die so gewonnene Fülle an Informationen aber nutzbar eingesetzt werden kann, muss sie einer breiten wissenschaftliche Gemeinschaft zugänglich und für sie nutzbar gemacht werden.“
Das Forschungsteam von der HHU, der Rutgers State University of New Jersey und der University of California in San Francisco stellt in der Veröffentlichung eine standardisierte Datenbeschreibung in Form von drei verknüpften „Wörterbüchern“ vor, die in einer gemeinsamen Bibliothek organisiert sind. Prof. Dr. Claus Seidel von der HHU, einer der beiden Korrespondenzautoren: „Dieses Organisationsprinzip mit kombinierten Wörterbüchern ermöglicht es Forschenden erstmals, integrative Strukturmodelle, die auf Fluoreszenzdaten beruhen, zusammen mit kinetischen Informationen zu hinterlegen. Gleichzeitig können die allgemeinen Definitionen so aber auch von anderen Methoden genutzt werden, um dynamische Eigenschaften von Biomolekülen neben deren Struktur in der Datenbank zu dokumentieren.“
Dieser Ansatz ist erforderlich, um statische Strukturmodelle mit der ihnen zugrundeliegenden Energielandschaft – also den Energieunterschieden zwischen unterschiedlichen dreidimensionalen Anordnungen der Bausteine innerhalb des Biomoleküls – zu verbinden. Prof. Seidel: „Diese Informationen ermöglichen, die nächste Generation von KI-basierten Programmen zur Vorhersage dynamischer biomolekularer Strukturen zu entwickeln und zu trainieren. Hier können die aus Fluoreszenzexperimenten gewonnenen Daten zur funktionsrelevanten Dynamik einen sehr wichtigen Beitrag leisten.“
Diese Arbeit wurde im Rahmen des ERC Advanced Grant von Prof. Seidel „hybridFRET“ durchgeführt.
Originalpublikation:
Christian A. Hanke, John D. Westbrook, Benjamin M. Webb, Thomas-O. Peulen, Catherine L. Lawson, Andrej Sali, Helen M. Berman, Claus A. M. Seidel & Brinda Vallat. Making fluorescence-based integrative structures and associated kinetic information accessible. Nature Methods (2024).
DOI: 10.1038/s41592-024-02428-x
Die semantisch ähnlichsten Pressemitteilungen im idw