Langsame Bearbeitung von Protein-Bauanleitungen führt zu Zelltod
Ein internationales Forscherteam hat einen neuen Mechanismus identifiziert, der für die Produktion von Zellproteinen entscheidend ist. Wenn dieser Mechanismus gestört ist, wird die Bearbeitung („Spleißen“) der Baupläne fehlerhaft, die die Zelle zur Herstellung von Proteinen verwendet. Die Arbeiten unter Federführung der Goethe-Universität Frankfurt könnten erklären, wie bestimmte Mutationen zur Netzhaut-Erkrankung Retinitis pigmentosa führen. Sie könnten aber auch den Weg zu neuen diagnostischen Tests und Therapien bei vielen anderen Krankheiten eröffnen, etwa bestimmten Krebsarten, Parkinson oder Alzheimer.
FRANKFURT. Gene enthalten die Bauanleitungen für das Leben: Sie instruieren die Zelle, welche Aminosäuren sie in welcher Reihenfolge hintereinander hängen muss, um ein bestimmtes Protein herzustellen. Das menschliche Genom besteht aus 20.000 solcher Anleitungen. „Dennoch können unsere Zellen damit mehrere Hunderttausend verschiedene Proteine produzieren“, erklärt Prof. Ivan Đikić vom Institut für Biochemie II der Goethe-Universität Frankfurt.
Verantwortlich dafür ist ein Prozess, der sich „Spleißen“ nennt. Wenn eine Zelle ein Protein benötigt, bestellt sie im Zellkern eine Abschrift der entsprechenden Anleitung. Diese Abschrift wird beim Spleißen modifiziert: Ein zellinternes Redaktionsbüro, das Spleißosom, schneidet bestimmte Passagen heraus. Je nachdem, welche Teile entfernt werden, entstehen so ganz unterschiedliche Anleitungen (und damit in Folge auch verschiedene Proteine).
Präzision des Spleiß-Vorgangs deutlich erhöht
Dieser Vorgang ist extrem wichtig für das Leben der Zelle. „Das Spleißosom besteht aus verschiedenen Komponenten, die die Produktion von funktionalen Proteinen sicherstellen, die das zelluläre Leben kontrollieren“, sagt Đikić. „Wird dieser Komplex bei seiner Arbeit beeinträchtigt, führt das zum Tod der betroffenen Zelle. Daher gelten entsprechende Hemmstoffe unter anderem als mögliche Medikamente gegen Krebs.“ Das Problem ist nur: Eine komplette Blockade des Redaktionsbüros setzt auch Zellen außer Gefecht, die völlig gesund sind. Die bislang untersuchten Wirkstoffe zur Hemmung des Spleißosoms haben daher immense Nebenwirkungen.
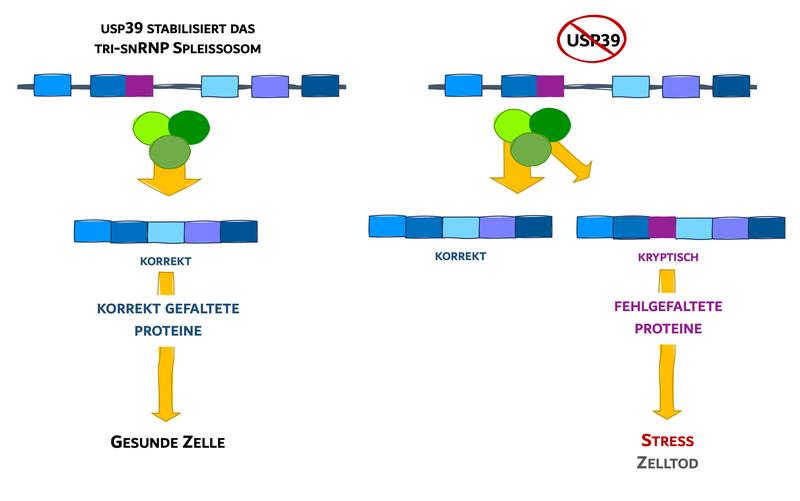
Die internationale Studie unter Federführung der Goethe-Universität hat nun einen Mechanismus identifiziert, der auf subtilere Art und Weise in den Spleiß-Vorgang eingreift. Er betrifft einen Teil des Spleißosoms, der aus drei Bausteinen besteht und als U4/U6.U5 bezeichnet wird. „Wir wussten, dass bei einer bestimmten Augenkrankheit – der Retinitis pigmentosa – Teile dieser Bausteine mutiert und dadurch verändert sind“, erklärt Dr. Cristian Prieto-Garcia vom Institut für Biochemie II, der Erstautor der Studie. „Wir wussten aber nicht, welche Folgen diese Mutationen genau haben.“
Experimente an Zebrafischen kombiniert mit mathematischen Berechnungen
In Experimenten mit Zebrafischen konnten die Forschenden diese Wissenslücke nun schließen. Demnach werden die Bausteine U4, U5 und U6 normalerweise durch ein Protein namens USP39 als dreiteiliger Komplex stabilisiert. Durch Mutationen in den Bausteinen oder das Fehlen von USP 39 wird das verhindert. Das wiederum führt dazu, dass das Spleißosom seine Aufgaben nicht mehr so genau wie zuvor erledigt. Normalerweise sorgt U4/U6.U5 dafür, dass direkt nach dem Auseinanderschneiden der Anleitung die Schnittkante sehr schnell mit dem dazu passenden Gegenstück verbunden wird. Wenn USP39 fehlt (oder die Bausteine mutiert sind), erfolgt diese Neuverknüpfung aber weitaus langsamer.
„Dadurch steigt die Wahrscheinlichkeit, dass es zu falschen Verknüpfungen kommt, wie wir in Computersimulationen zeigen konnten“, erläutert Prieto-Garcia. So entstehen fehlerhaft redigierte Abschriften, auf deren Basis die Zelle dann dysfunktionale Proteine herstellt. Diese sammeln sich in ihrem Innern an und verklumpen. Allerdings verfügen Zellen über eine Art Müllabfuhr, mit deren Hilfe sie fehlerhafte Moleküle entsorgen können. Dieser Schutzmechanismus wurde in Zellen aktiviert, wenn USP39 fehlte. Nach einiger Zeit war die „Müllabfuhr“ aber von den Verklumpungen überfordert, und die betroffenen Zellen in der Fisch-Netzhaut starben ab.
Überraschende Entdeckung
„Die Entdeckung dieses Mechanismus hat uns selbst überrascht“, betont Prof. Đikić. „Wir vermuten, dass er auch beim Menschen erklärt, warum die Netzhautzellen bei Retinitis pigmentosa zu Grunde gehen. Diese fehlerhaften Verknüpfungen könnten darüber hinaus auch bei der Entstehung von neurodegenerativen Erkrankungen, beispielsweise bei Alzheimer oder Parkinson, relevant sein. Andererseits könnte sich aus diesem Mechanismus auch neue Behandlungsansätze für Krebsarten ergeben, die in hohem Maße von einer korrekten Funktion des Spleißosoms abhängig sind.
So produzieren manche besonders aggressive Tumore große Mengen an USP39 und verwandter Spleißfaktoren. Grund dafür ist vermutlich ihre hohe Teilungsrate: Da sie dafür ständig große Mengen Proteine herstellen, sind sie auf ein möglichst exaktes Spleißing angewiesen. Das USP39 stellt diese Genauigkeit sicher. „Möglicherweise ließen sich diese Krebszellen selektiv abtöten, wenn man das USP39 in ihnen blockiert“, sagt der Wissenschaftler. „Gesunde Zellen mit ihrer weit niedrigeren Teilungs-Aktivität blieben dagegen verschont. Das ist ein Ansatz, den wir momentan untersuchen.“
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Ivan Đikić
Gruppenleiter „Molecular Signaling“
Institut für Biochemie II
Goethe-Universität Frankfurt
Telefon: +49 (0) 69 6301-5652
dikic@biochem2.uni-frankfurt.de
Homepage: https://biochem2.com/research-group/molecular-signaling
Originalpublikation:
Cristian Prieto-Garcia, Vigor Matkovic, Thorsten Mosler, Congxin Li, Jie Liang, James A. Oo, Felix Haidle, Igor Macinković, Alfredo Cabrera-Orefice, Rayene Berkane, Giulio Giuliani, Fenfen Xu, Anne-Claire Jacomin, Ines Tomaskovic, Marion Basoglu, Marina E. Hoffmann, Rajeshwari Rathore, Ronay Cetin, Doha Boutguetait, Süleyman Bozkurt, María Clara Hernández Cañás, Mario Keller, Jonas Busam , Varun Jayeshkumar Shah, Ilka Wittig, Manuel Kaulich, Petra Beli, Wojciech P. Galej, Ingo Ebersberger, Likun Wang, Christian Münch, Alexandra Stolz, Ralf P. Brandes, William Ka Fai Tse, Stefan Eimer, Didier Y. R. Stainier, Stefan Legewie, Kathi Zarnack, Michaela Müller-McNicoll, Ivan Dikic: Pathogenic proteotoxicity of cryptic splicing is alleviated by ubiquitination and ER-phagy. Science (2024); https://doi.org/10.1126/science.adi5295
Die semantisch ähnlichsten Pressemitteilungen im idw