Flüssige Wassermoleküle sind von Natur aus asymmetrisch: Neue Einblicke in die Bindungen zwischen Wassermolekülen
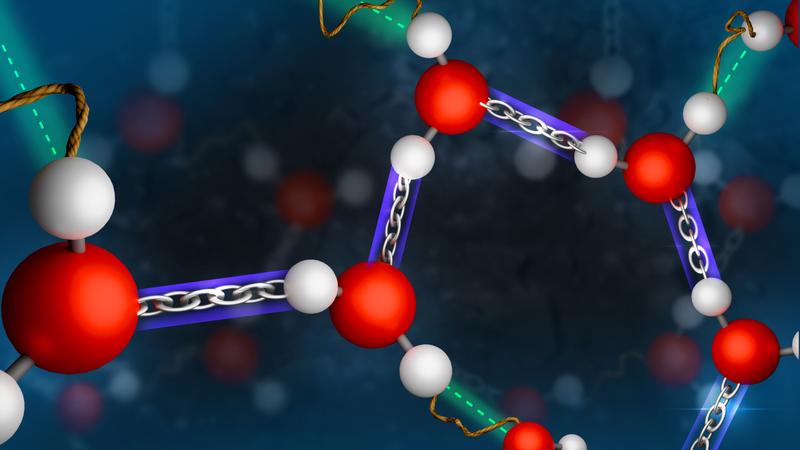
Eisberge schwimmen auf Wasser, 4 °C kaltes Wasser sinkt auf den Grund: Wasser gibt mit seinen Anomalien auch heute noch Rätsel auf. Forschende um Johannes Hunger am Max-Planck-Institut für Polymerforschung haben die Bindungen zwischen Wassermolekülen und seinen Nachbarn in der flüssigen Phase untersucht. Sie haben festgestellt, dass die Abstände zu benachbarten Molekülen nicht statistisch zufällig sind: Die beiden Wasserstoffatome eines einzelnen Wassermoleküls bilden eine starke und eine schwache Bindung mit benachbarten Molekülen. Somit können sich kurzfristige Überstrukturen wie Ringe oder Ketten ausbilden - ein wichtiger Baustein für ein umfassendes Verständnis der Struktur von Wasser.
Eisberge schwimmen auf Wasser, denn das darunter liegende, flüssige Wasser hat eine höhere Dichte als der Eisberg. Flüssiges Wasser selbst hat seine höchste Dichte bei 4°C – eine der vielen sogenannten Anomalien des Wassers, also Eigenschaften von Flüssigkeiten die so nur selten zu finden sind.
Warum dies so ist, ist schon lange Gegenstand wissenschaftlicher Untersuchungen. Forschende am Max-Planck-Institut für Polymerforschung haben nun einen weiteren Baustein entdeckt, der Einblicke in das besondere Verhalten von Wasser gibt.
Viele der besonderen Eigenschaften von Wasser beruhen auf den speziellen Wechselwirkungen zwischen den einzelnen Wassermolekülen – den sogenannten Wasserstoffbrückenbindungen. Jedes Wassermolekül kann zwei dieser Bindungen ausbilden - eine von jedem Wasserstoffatom - und zwei von anderen, benachbarten Molekülen aufnehmen. Anders als in Eis, werden diese Bindungen in flüssigem Wasser im Schnitt 1 Billion mal pro Sekunde gebrochen und wieder neu gebildet, so dass sich die Wassermoleküle dichter packen lassen und sich sehr schnell bewegen können. Durch die schnelle Bewegung der Wassermoleküle in der Flüssigkeit könnte man vermuten, dass die Stärke der einzelnen Bindungen zu seinen Nachbarn rein zufällig ist.
Das Team um Gruppenleiter Johannes Hunger hat jedoch festgestellt, dass die Wasserstoffbrücken nicht einfach zufällig ausgebildet werden, sondern je zwei Bindungen eines Moleküls unterschiedlich stark sind: Ist eine Bindung sehr stark – d. h. das erste Nachbar-Wassermolekül sehr nah – ist die zweite Wasserstoffbrücke schwach – d. h. das zweite Nachbar-Wassermolekül weiter entfernt.
Hierdurch ergibt sich in der eigentlich molekular ungeordneten Flüssigkeit eine Struktur: Hangelt man sich von einem Wassermolekül weiter zum nächsten und zum übernächsten, gibt es immer ein stark gebundenes Nachbarmolekül. Dadurch können in der Flüssigkeit Strukturen wie z. B. Ringe oder Ketten aus Wassermolekülen entstehen. Die Struktur von flüssigem Wasser ist somit nicht nur eine zufällige Anordnung von einzelnen Wassermolekülen sondern folgt bestimmten Regeln.
Die Wissenschaftler*innen haben, um zu diesen Ergebnissen zu gelangen, Wasser mit einem Lösemittel verdünnt, so dass sie einzelne, isolierte Wassermoleküle untersuchen konnten. Mit Hilfe von Lasern haben sie einzelne Atome der Wassermoleküle zum Schwingen gebracht und untersucht, wie sich die einzelnen Schwingungen gegenseitig beeinflussen. Somit konnten sie die Stärke einzelner Wasserstoffbrückenbindungen und gleichzeitig die Stärke der benachbarten Bindung vermessen.
Die nun im Journal „Nature Communications“ veröffentlichte Studie trägt dazu bei, in Zukunft die Anomalien des Wassers auch auf molekularer Ebene umfassend zu verstehen.
Wissenschaftlicher Ansprechpartner:
Dr. Johannes Hunger
hunger@mpip-mainz.mpg.de
Originalpublikation:
Lucas Gunkel, Amelie A. Ehrhard, Carola S. Krevert, Bogdan A. Marekha, Mischa Bonn, Maksim Grechko & Johannes Hunger: Dynamic anti-correlations of water hydrogen bonds, Nature Communications | (2024)
https://doi.org/10.1038/s41467-024-54804-y
Weitere Informationen:
https://www.mpip-mainz.mpg.de/988689/PM2024-12
Ähnliche Pressemitteilungen im idw