Organoide bilden erstmals die komplexe Zelllandschaft von Bauchspeicheldrüsenkrebs ab
Ein Team um Forschende der Technischen Universität München (TUM) hat erstmals Tumor-Organoide – dreidimensionale Miniaturtumore – im Labor gezüchtet, welche die unterschiedlichen Strukturen und Eigenschaften von Bauchspeicheldrüsenkrebs nachbilden. Die Wissenschaftlerinnen und Wissenschaftler haben untersucht, wie die verschiedenen Tumor-Organoide auf etablierte und neuartige Behandlungen reagieren. Dies eröffnet neue Möglichkeiten für die Entwicklung effektiver Therapien.
Bauchspeicheldrüsenkrebs gehört zu den Krebserkrankungen mit besonders niedriger Überlebensrate. Einer der Gründe ist das Fehlen wirksamer Behandlungen. Das liegt unter anderem daran, dass die Krebszellen eines Tumors sehr unterschiedlich auf ein und dieselbe Therapie reagieren können. Die Zellen eines Bauchspeicheldrüsentumors unterscheiden sich nicht nur stark in ihrer Struktur, sondern auch in ihren damit verknüpften biologischen Eigenschaften, beispielsweise wie aggressiv sie sind.
Grob kann man Bauchspeicheldrüsenkrebszellen aufgrund ihrer Erscheinung und ihres molekularen Profils in zwei Subtypen einteilen: epithelial und mesenchymal. „Die Tumorzellen können allerdings im Lauf der Krankheit ihre Struktur und Funktion verändern. Inzwischen ist bekannt, dass es innerhalb dieser beiden Subtypen ein großes Spektrum verschiedener Erscheinungsformen gibt, die sich sehr unterschiedlich verhalten können“, sagt Maximilian Reichert, Professor für Translationale Pankreaskarzinomforschung am Klinikum rechts der Isar der TUM.
Vielfältige Strukturen im Labor nachgezüchtet
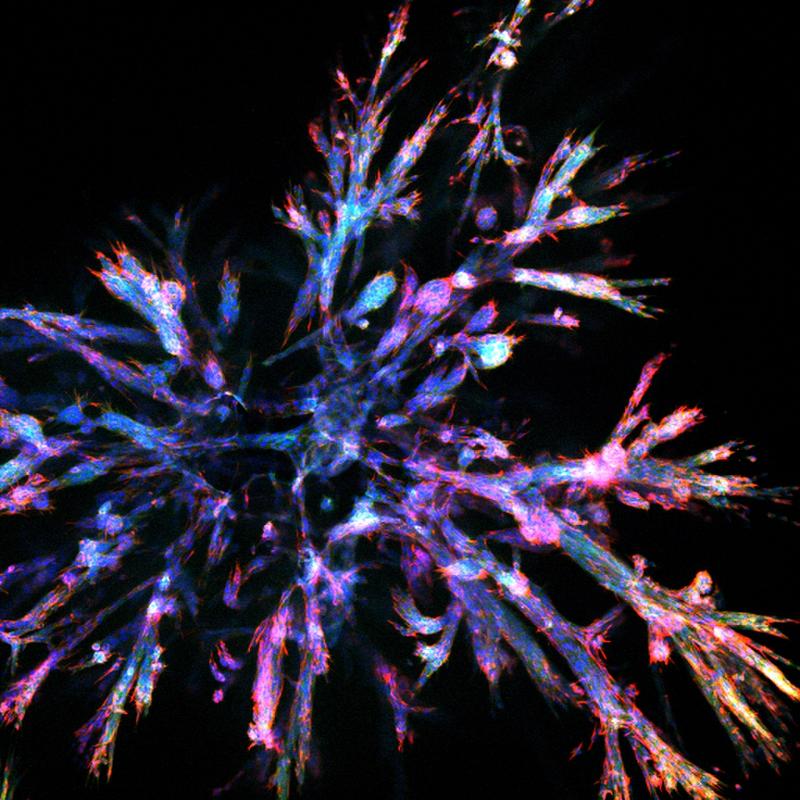
Ein Team um Reichert hat nun erstmalig die zelluläre Komplexität von Bauchspeicheldrüsenkrebs im Labor nachgebildet. „Tumorzellverbände sind im Körper drüsenartig geformt, mit vielen gangähnlichen Verzweigungen. Entnimmt man einzelne Tumorzellen und züchtet daraus im Labor künstliche, dreidimensionale Zellkulturen, Organoide genannt, erhält man nach der üblichen Vorgehensweise aber nur unverzweigte, runde Strukturen. Diese haben nicht die gleichen Eigenschaften wie die Zellverbände im Körper“, sagt Aristeidis Papargyriou, Erstautor der Studie. „Wir können jetzt Organoide erzeugen, die den echten, verzweigten Zellverbänden sehr ähnlich sind. Damit können wir erstmals die Vielfalt von Bauchspeicheldrüsenkrebs im Labor abbilden.“
Welche Therapie wirkt? Verschiedene Organoide reagieren unterschiedlich
Mit Hilfe von maschinellem Lernen haben sie die neu gezüchteten Organoide anhand ihrer Strukturen in definierte Gruppen unterteilt, um damit systematisch weiterarbeiten zu können. „Wir haben verschiedene Phänotypen innerhalb der beiden großen Kategorien epithelial und mesenchymal identifiziert. Das sind vereinfach gesagt Gruppen, die sich in Aussehen, Physiologie und Verhalten unterscheiden“, sagt Aristeidis Papargyriou.
Zunächst haben sie mit Organoiden aus Maustumorzellen gearbeitet. „Beispielsweise sind ‚Sternartige Organoide‘ in der Mitte rund und nach außen hin besonders stark verzweigt, während ‚TEBBO-Organoide‘ dicke Verästelungen und stumpfe Enden haben.“ Diese Phänotypen unterscheiden sich nicht nur stark in ihrem Aussehen, sondern unter anderem auch darin, wie sie sich vermehren, Stoffwechsel betreiben oder sich bei Sauerstoffmangel verhalten. Insbesondere reagieren sie auch unterschiedlich auf Behandlungen: So waren beispielsweise die sternartigen Organoide gegen das in der Studie eingesetzte Chemotherapeutikum resistent, sprachen aber stark auf Bestrahlung an.
Auf dieser Grundlage gelang es ihnen, auch erste Bauchspeicheldrüsenkrebs-Phänotypen aus Krebszellen von Patientinnen und Patienten im Labor zu züchten und auf Behandlungen zu testen.
Ansätze für zukünftige Therapien
Die neuen Organoide könnten für die Entwicklung von Therapien von Nutzen sein. Wenn bekannt ist, welche Phänotypen bei einer Patientin oder einem Patienten vorkommen und wie diese auf Behandlungen reagieren, könnten Ärztinnen und Ärzte Therapien individueller und gezielter ausrichten.
Die Forschenden verfolgen auch noch einen weiteren Ansatz, um aus dem Wissen zukünftig effektivere Behandlungen zu entwickeln. „Mehrere Phänotypen eines Tumors gleichzeitig zu bekämpfen ist sehr schwierig. Behandelt man sie mit dem gleichen Medikament, reagieren sie möglicherweise völlig unterschiedlich oder weichen der Behandlung aus indem sie sich in andere Phänotypen umwandeln und werden therapieresistent“, sagt Reichert. „Deswegen war unsere Idee, zunächst die Anzahl verschiedener Phänotypen innerhalb eines Tumors zu reduzieren, bis im Idealfall nur noch sehr wenige übrigbleiben, die sich nicht weiter verändern. Für diese verbliebenen könnte man eine Therapie entwickeln und sie so in einem zweiten Schritt gezielt bekämpfen.“
Die Forschenden testeten diesen Ansatz an den neuentwickelten Organoiden und gaben dafür verschiedene Wirkstoffe dazu. Manche Phänotypen wurden dadurch verdrängt, andere wandelten sich um oder entwickelten sich zu neuen Phänotypen. Übrig blieben wie beabsichtigt hauptsächlich nur noch zwei Phänotypen, die sich nicht weiter veränderten. Für diese wollen die Forschenden zukünftig Substanzen finden, mit denen sie sich behandeln lassen, und den Ansatz weiterentwickeln.
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Maximilian Reichert
Technische Universität München
Professur für Translationale Pankreaskarzinomforschung
maximilian.reichert@tum.de
Originalpublikation:
Papargyriou, A., Najajreh, M., Cook, D.P. et al.: Heterogeneity-driven phenotypic plasticity and treatment response in branched-organoid models of pancreatic ductal adenocarcinoma. Nat. Biomed. Eng (2024). DOI: https://doi.org/10.1038/s41551-024-01273-9
Weitere Informationen:
https://www.cos.tum.de/ TUM Center for Organoid Systems (COS)
https://www.bioengineering.tum.de/ Munich Institute of Biomedical Engineering (MIBE)
https://www.med2.mri.tum.de/de/forschung/klinische-forschung/translationale_pankreaskarzinomforschung.php
Die semantisch ähnlichsten Pressemitteilungen im idw