Energieschub schützt Krebszellen gegen mechanischen Stress
Krebszellen reagieren auf mechanischen Druck mit einem Energieschub, der ihnen hilft, DNA-Schäden zu reparieren und in beengten Umgebungen des Körpers zu überleben. Ein Team um Verena Ruprecht von der Universität Innsbruck und Sara Sdelci vom Centre for Genomic Regulation (CRG) in Barcelona hat diesen Schutzmechanismus von Krebszellen erstmals beschrieben. Die Entdeckung ebnet den Weg für neue Strategien zur Eindämmung der Tumorausbreitung.
Krebszellen steigern sofort die Energieproduktion, wenn sie unter mechanischen Stress geraten. Das zeigt eine kürzlich in der Fachzeitschrift Nature Communications erschienene Studie. Dieser Energieschub ist der erste beobachtete Schutzmechanismus, der den Zellen hilft, DNA-Schäden zu reparieren und in beengten Umgebungen des menschlichen Körpers zu überleben.
Krebszellen kriechen durch das Gewebe, gleiten in poröse Blutgefäße und werden im Blut herumgeschleudert. Die aktuellen Ergebnisse helfen zu verstehen, wie sie diese komplexen mechanischen Herausforderungen überstehen. Die Entdeckung dieses Mechanismus kann zu neuen Strategien führen, mit denen Krebszellen eingedämmt werden können, bevor sie sich im Körper ausbreiten.
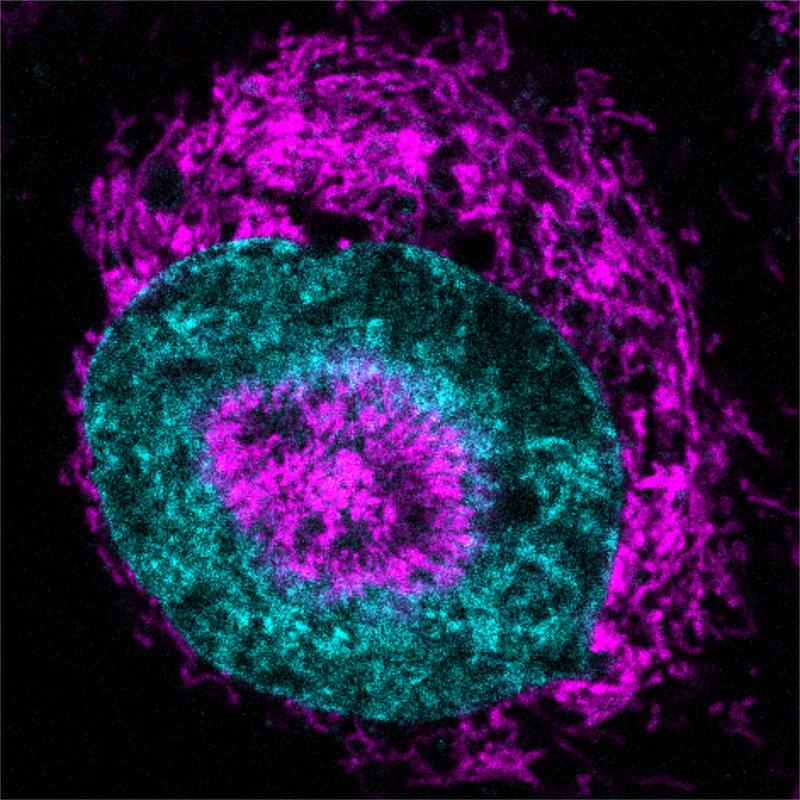
Das Forschungsteam um Verena Ruprecht am Institut für Zoologie der Universität Innsbruck und am Centre for Genomic Regulation (CRG) in Barcelona machte diese Entdeckung mithilfe moderner Mikroskopiemethoden und dem biomimetischen Nachbau von Gewebestress, womit lebende Zellen auf eine Breite von nur drei Mikrometern komprimieren werden können. Das entspricht etwa einem Dreißigstel des Durchmessers eines menschlichen Haares. Sie beobachteten, dass innerhalb von Sekunden nach dem Zusammendrücken die Mitochondrien in HeLA-Zellen (eine in der Forschung häufig eingesetzte Krebszelllinie) zur Oberfläche des Zellkerns wandern und zusätzliches ATP – die molekulare Energiequelle der Zellen – in den Zellkern pumpen.
Agile Ersthelfer rollen an
„Das zwingt uns dazu, die Rolle der Mitochondrien im menschlichen Körper neu zu überdenken. Sie sind keine statischen Batterien, die unsere Zellen mit Energie versorgen, sondern eher agile Ersthelfer, die in Notfällen herbeigerufen werden können, wenn die Zellen buchstäblich an ihre Grenzen stoßen“, sagt Sara Sdelci vom CRG in Barcelona.
Die Mitochondrien bilden eine so dichte Ansammlung um den Zellkern, dass sich dieser nach innen wölbt. Dieses Phänomen wurde bei 84 % der eingequetschten HeLa-Krebszellen beobachtet, während es bei nicht komprimierten Zellen so gut wie gar nicht auftrat. Die Forscher:innen bezeichnen diese Strukturen als „NAMs“ (nucleus-associated mitochondria, mit dem Zellkern verbundene Mitochondrien).
Um herauszufinden, was NAMs tun, setzten das Forschungsteam einen fluoreszierenden Sensor ein, der aufleuchtet, wenn ATP in den Zellkern gelangt. Das Signal stieg innerhalb von drei Sekunden nach dem Zusammendrücken der Zellen um etwa 60 Prozent an. „Das ist ein klares Zeichen dafür, dass sich die Zellen an die Belastung anpassen und ihren Stoffwechsel umstellen“, sagt Fabio Pezzano, einer der Erstautoren der Studie.
ATP-hungrige Reparaturteams versorgen
Nachfolgende Experimente zeigten, warum der Energieschub von Bedeutung ist. Durch mechanisches Zusammendrücken wird auch das Erbgut gequetscht, wodurch DNA-Stränge reißen und Schäden im menschlichen Genom entstehen. Zellen sind auf ATP-hungrige Reparaturteams angewiesen, um die DNA zu lockern, beschädigte Stellen zu erreichen und den Schaden zu beheben. Zusammengedrückte Zellen, die zusätzliches ATP produzierten, reparierten die DNA innerhalb weniger Stunden, während Zellen ohne diesen Energieschub Fehler anhäuften und sich nicht mehr richtig teilen konnten.
Um die Relevanz bei Krebserkrankungen zu belegen, untersuchte das Team auch Gewebe von 17 Patientinnen mit Brustkrebs. Die NAM-Ansammlungen traten bei 5,4 % der Zellkerne an Tumorgrenzen auf, gegenüber 1,8 % im dichten Tumorkern, was einem dreifachen Wert entspricht. „Als wir dies in den Biopsien der Patientinnen gesehen haben, war uns klar, welche Relevanz die Entdeckung über das Labor hinaus hat“, erklärt Ritobrata (Rito) Ghose, ebenfalls Erstautor der Studie.
Das Forschungsteam konnte auch den zellulären Mechanismus untersuchen, der den mitochondrialen Energieschub ermöglicht. Aktinfilamente, dieselben Proteinpolymere, die auch Muskeln beugen lassen, lagern sich um den Zellkern herum an, während das Endoplasmatische Retikulum ein netzartiges Geflecht bildet. Die Studie zeigt nun, dass dieses kombinierte Gerüst die NAMs physisch an Ort und Stelle festhält und so die haloähnliche Struktur aus Mitochondrien um den Zellkern bildet. Als die Forscher:innen die Zellen mit Latrunculin A behandelten, einem Toxin, das Aktin abbaut, brach die NAM-Bildung zusammen und der ATP-Strom ebbte ab.
Mechanische Stressreaktionen wenig erforscht
Wenn metastasierende Zellen von NAM-gesteuerten Energieschüben abhängig sind, könnten Medikamente, die das Zellgerüst stören, Tumore weniger invasiv machen, ohne die Mitochondrien umfassend zu schädigen und gesundes Gewebe zu schonen. „Mechanische Stressreaktionen sind eine noch wenig erforschte Schwachstelle von Krebszellen, die neue therapeutische Wege eröffnen kann“, sagt Verena Ruprecht.
Die Studie befasste sich zwar mit Krebszellen, doch die Autor:innen betonen, dass es sich hierbei wahrscheinlich um ein universelles Phänomen in der Biologie handelt. Immunzellen, die sich durch Lymphknoten quetschen, Neuronen, die ihre Verzweigungen ausdehnen, und embryonale Zellen während der Morphogenese sind alle ähnlichen physikalischen Kräften ausgesetzt. „Wo immer Zellen unter Druck geraten, sorgt wahrscheinlich ein Anstieg der Zellenergie für den Schutz des Genoms“, folgert Verena Ruprecht. „Das ist eine völlig neue Ebene der Regulation in der Zellbiologie, die unser Verständnis davon, wie Zellen Phasen intensiver physischer Belastung überstehen, grundlegend verändert.“
Wissenschaftlicher Ansprechpartner:
Univ. Prof. Dr. Verena Ruprecht
Institut für Zoologie
Universität Innsbruck
+43 512 507 51860
verena.ruprecht@uibk.ac.at
Originalpublikation:
Mitochondria-derived nuclear ATP surge protects against confinement-induced proliferation defects. Ritobrata Ghose, Fabio Pezzano, Savvas Kourtis, Ilir Sheraj, Shubhamay Das, Antoni Gañez Zapater, Upamanyu Ghose, Lorena Espinar, Katja Parapatics, Valeria Venturini, André C Müller, Verena Ruprecht, Sara Sdelci. Nature Communications 2025 DOI: https://doi.org/10.1038/s41467-025-61787-x [bioRxiv: https://www.biorxiv.org/content/10.1101/2023.12.20.572417v1]
Ähnliche Pressemitteilungen im idw