Neue Studie kartiert Bindungsstellen von Proteinen über verschiedene Spezies hinweg
Wissenschaftler erhalten erstmals umfassende Einblick über das „Pocketom“ mithilfe von KI-vorhergesagten Proteinstrukturen
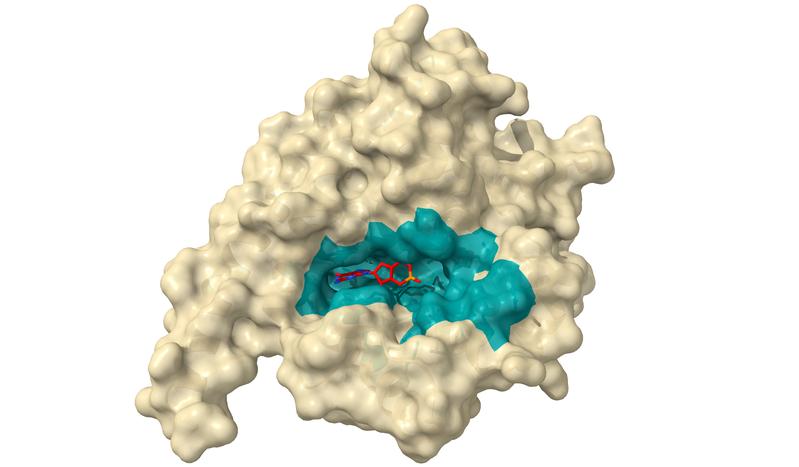
Proteine erfüllen ihre vielfältigen Funktionen durch physikalische Wechselwirkungen mit anderen Molekülen. Insbesondere mit kleinen Molekülen, die in Zellen vorkommen, wie beispielsweise Metaboliten. Diese Wechselwirkungen finden an bestimmten Bindungsstellen auf der Oberfläche von Proteinen statt. Wissenschaftler des MPI-MP haben nun eine systematische Untersuchung aller Bindungsstellen – des „Pocketoms” – bei elf verschiedenen Arten aus unterschiedlichen Lebensbereichen durchgeführt.
Mithilfe von über 220.000 KI-vorhergesagten Proteinstrukturen aus der AlphaFold-Datenbank und hochentwickelten computergestützten Taschenerkennungswerkzeugen identifizierten die Bioinformatiker Hanne Zillmer und Dirk Walther fast 100.000 potenzielle Bindungsstellen in den elf Arten. Sie verglichen und gruppierten diese Stellen innerhalb und zwischen den Arten und erstellten eine globale „Karte” der Bindungsstellen und ihrer zugehörigen Merkmale. Zu den analysierten Proteomen gehörten diejenigen von Menschen, Mäusen, Hefen, dem Darmbakterium E. coli und einer Nematodenart sowie wichtige Nutzpflanzenarten wie Reis und Mais.
„Die Verfügbarkeit von KI-basierten und zuverlässig vorhergesagten Proteinstrukturen, wie sie von AlphaFold generiert werden, ermöglicht nun eine beispiellose Breite und Tiefe struktureller Untersuchungen”, sagt Doktorandin Hanne Zillmer.
Die Studie offenbarte einen überraschenden evolutionären Trend: Mit der Entwicklung komplexerer Proteome – Proteom: die Gesamtheit aller Proteine einer Spezies – nahm die Vielfalt ihrer Bindungsstellen sublinear zu. Einfacher ausgedrückt: Während die Anzahl der Proteine mit der Evolution zunahm, wuchs die Anzahl der unterschiedlichen molekularen Interaktionsstellen weniger als proportional, was auf mögliche Grenzen oder geringen Bedarf an strukturellen und funktionellen Innovationen hindeutet.
„Wir hatten erwartet, dass mehr Proteine proportional zu einer größeren Vielfalt an Interaktionsstellen führen würden“, sagt Dr. Walther, Professor für Bioinformatik, „stattdessen scheint die Evolution entweder bei der Gestaltung völlig neuer Bindungsstellen eingeschränkt zu sein, oder es besteht nur ein begrenzter Bedarf an völlig neuen Interaktionsmodi.“
„Mit dieser nun verfügbaren umfassenden Übersicht über die Pocketome verschiedener Spezies wird eine systematische Untersuchung der molekularen Interaktionen zwischen Proteinen und kleinen Molekülen sowie das Verständnis der spezies- oder gattungsspezifischen Bindungsmodi erheblich erleichtert“, sagt Hanne Zillmer.
Darüber hinaus liefert die Forschung eine Perspektive über viele Spezies hinweg, die in diesem Bereich bisher weitgehend fehlte. Während sich die meisten früheren Studien auf biomedizinische Anwendungen und die Arzneimittelwirksamkeit von Bindungsstellen oder Unterschiede zwischen Arzneimittel-Protein- und Metabolit-Protein-Bindungsereignissen konzentrierten, betont diese Studie die evolutionären Trends und die strukturelle Vielfalt im gesamten Stammbaum des Lebens. Artenübergreifende Vergleiche werden beispielsweise auch dazu beitragen, sicherere Agrochemikalien zu entwickeln, die speziell auf Krankheitserreger abzielen, aber in Bestäubern oder Menschen inaktiv sind.
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Dirk Walther
Group Leader Bioinformatics
+49 331 567-8108
walther@mpimp-golm.mpg.de
Originalpublikation:
Zillmer H, Walther D (2025). Towards a comprehensive view of the pocketome universe—biological implications and algorithmic challenges. PLoS Computational Biology. https://doi.org/10.1371/journal.pcbi.1013298
Weitere Informationen:
https://Der vollständige Datensatz, Visualisierungen und Software-Tools sind als Open Source verfügbar unter: https://github.com/zillmerhanne/PocketomeUniverse
https://www.mpimp-golm.mpg.de/2800820/news_publication_25415084_transferred?c=4084
Ähnliche Pressemitteilungen im idw